题目
铜及其化合物在生产、生活中都有广泛的应用。探究一、铜的性质及其应用(1)化学小组用一定量AgNO3和Al(NO3)3的混合溶液加入铜粉和锌粉,充分反应后过滤,得到溶液甲和固体乙,下列说法正确的是 ____ (填序号)。A.溶液甲中一定含有Al(NO3)3和Zn(NO3)2B.固体乙中一定含有Ag,可能含有Cu和ZnC.若溶液甲是蓝色,则溶液甲一定含有Al(NO3)3、Zn(NO3)2和Cu(NO3)2D.向固体乙上滴加盐酸有气泡产生,则溶液甲中一定没有AgNO3和Cu(NO3)2(2)碳还原氧化铜的实验装置如图甲、乙所示。C+CuO 气体-|||-澄清的-|||-图 石灰水-|||-甲-|||-K CuO+C-|||-足量-|||-澄清 硫-|||-浓-|||-石灰水 酸-|||-B c DⅠ.甲图中酒精灯上网罩的作用是 ____ 。[提出问题]碳燃烧时可能生成CO2也可能生成CO,那么碳与氧化铜反应生成的气体是否也有多种可能?[作出猜想]猜想①:CO;猜想②:CO2;猜想③:CO和CO2。[设计方案]实验装置如图乙。打开K,缓缓通入干燥的氮气一段时间,关闭K,点燃酒精喷灯和酒精灯,充分反应后,熄灭酒精喷灯和酒精灯,打开K,再通一段时间氮气。方案一:从定性观察角度判断若B中无明显实验现象,D处气体能被点燃,则猜想①成立。方案二:从定量计算角度判断取一定量炭粉和4g氧化铜的混合物进行实验,并测定表格中的四个数据: 反应前的质量 反应后的质量 A(玻璃管+固体) m1 m2 B+C(广口瓶+混合液) m3 m4 Ⅱ.若猜想②成立,则理论上(m4-m3) ____ (填“<”“=”或“>”)(m1-m2)。Ⅲ.若猜想③成立且CuO全部转化成Cu,则参加反应的碳的质量m的取值范围是 ____ 。(3)兔首和鼠首均为青铜器(铜、锡合金),表面呈绿色,这是铜器长期暴露在空气中生成了铜锈(铜锈俗称铜绿)。青铜器属于 ____ (填序号)。铜绿Cu2(OH)2CO3分解的化学方程式为 ____ 。A.无机材料B.合成材料C.复合材料D.复合肥为了弄清铜生成铜绿的条件,某化学实验小组借鉴课本“铁钉锈蚀条件的探究”实验,设计了“铜片锈蚀条件的探究”实验,实验如图1所示(所用铜片洁净、光亮)。C+CuO 气体-|||-澄清的-|||-图 石灰水-|||-甲-|||-K CuO+C-|||-足量-|||-澄清 硫-|||-浓-|||-石灰水 酸-|||-B c D实验较长时间后,发现 ____ (填试管编号)试管中铜片最先生锈。小组讨论后发现实验还不够完善,要得出正确的结论,还要补充一个实验。你认为要补充的一个实验是:Cu和 ____ (写出试管中需要的物质)。可以省略不做的实验是试管 ____ (填试管编号)。探究二、铜的制备研究铜可采用如下方法制备:方法一:火法炼铜:Cu2S+O2(underline(;高温;))/(;)2Cu+SO2方法二:湿法炼铜:CuSO4+Fe═FeSO4+Cu(4)上述两种方法中,你认为哪种方法更好,原因是 ____ 。辉铜矿的主要成分为Cu2S,常用于火法炼铜。若生成过程中铜元素的转化率为90%,生产64t Cu需要含Cu2S 80%的辉铜矿 ____ t。(保留一位小数)探究三、铜的化合物的制备研究碱式碳酸铜可用于生产木材防腐剂等。工业上可用微蚀刻废液(含有一定量Cu2+、H+、SO42-、H2O2和微量Fe3+)制备高纯度碱式碳酸铜,其制备过程如图2:C+CuO 气体-|||-澄清的-|||-图 石灰水-|||-甲-|||-K CuO+C-|||-足量-|||-澄清 硫-|||-浓-|||-石灰水 酸-|||-B c D(5)加入试剂1的目的是除去废液中的酸性物质,试剂1最好选用 ____ (填序号)。a.Fe2O3b.CaCO3c.CuO(6)加入Na2CO3沉淀前须除去Fe3+,否则Fe2(SO4)3会与Na2CO3反应,产生一种气体,同时生成NaFe3(OH)6(SO4)2沉淀,影响产品质量,请写出反应的化学方程式 ____ 。(7)加入Na2CO3沉淀时,反应液pH对产品中的SO42-含量以及反应液中Cu2+沉淀效率的影响如图3所示,第二次沉淀时溶液pH最好控制在 ____ 。(8)所制得的碱式碳酸铜的组成可表示为:xCuCO3•yCu(OH)2•zH2O。某研究小组设计如图4实验装置测定其中CuCO3的质量分数(不考虑植物油中溶解CO2产生的影响)。C+CuO 气体-|||-澄清的-|||-图 石灰水-|||-甲-|||-K CuO+C-|||-足量-|||-澄清 硫-|||-浓-|||-石灰水 酸-|||-B c D实验步骤如下:①连接装置并检验装置气密性;②准确称量样品的质量1.2g;③装药品,调节量气装置两边液面相平,读取量气管刻度为10mL;④向锥形瓶内加入50mL(足量)的稀硫酸,充分反应;⑤冷却到室温;⑥再次调节量气装置两边液面相平,读取量气管刻度为172mL。Ⅰ.步骤一中检验装置气密性的方法是 ____ 。Ⅱ.装置B的作用是 ____ ,C中的试剂是 ____ (填序号)。a.碱石灰b.浓硫酸c.无水硫酸铜Ⅲ.步骤⑥中调节液面相平的操作是 ____ 。Ⅳ.若标准状况下,每44g二氧化碳的体积为22.4L。根据实验数据计算产品中CuCO3的质量分数(写出计算过程,保留到0.1%)。计算过程:Ⅴ.若其他操作均正确,仅因下列因素可使测定结果偏小的是 ____ (填序号)。A.步骤③中平视刻度,步骤⑥中仰视读数B.硫酸的用量不足C.量气管中未加植物油D.步骤⑥中没有调节量气装置两边液面相平,直接读数(9)碱式碳酸铜【xCuCO3•yCu(OH)2•zH2O】的热分解研究。小组同学用热分析仪对固体进行热分解,获得相关数据,绘成的固体质量与分解温度的关系如图5。(已知Cu(OH)2的分解温度小于CuCO3的分解温度。)Ⅰ.通过计算可得x:y:z= ____ 。Ⅱ.若将16.0g剩余固体继续加热到更高的温度,发现固体质量减少了1.6g后质量不再改变,写出此过程中可能发生反应的化学方程式: ____ 。
铜及其化合物在生产、生活中都有广泛的应用。
探究一、铜的性质及其应用
(1)化学小组用一定量AgNO3和Al(NO3)3的混合溶液加入铜粉和锌粉,充分反应后过滤,得到溶液甲和固体乙,下列说法正确的是 ____ (填序号)。
A.溶液甲中一定含有Al(NO3)3和Zn(NO3)2
B.固体乙中一定含有Ag,可能含有Cu和Zn
C.若溶液甲是蓝色,则溶液甲一定含有Al(NO3)3、Zn(NO3)2和Cu(NO3)2
D.向固体乙上滴加盐酸有气泡产生,则溶液甲中一定没有AgNO3和Cu(NO3)2
(2)碳还原氧化铜的实验装置如图甲、乙所示。
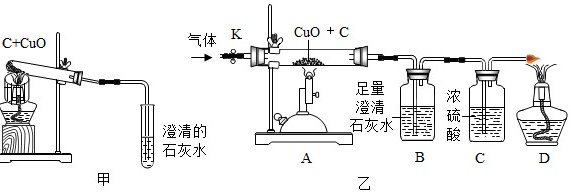
Ⅰ.甲图中酒精灯上网罩的作用是 ____ 。
[提出问题]碳燃烧时可能生成CO2也可能生成CO,那么碳与氧化铜反应生成的气体是否也有多种可能?
[作出猜想]猜想①:CO;猜想②:CO2;猜想③:CO和CO2。
[设计方案]实验装置如图乙。打开K,缓缓通入干燥的氮气一段时间,关闭K,点燃酒精喷灯和酒精灯,充分反应后,熄灭酒精喷灯和酒精灯,打开K,再通一段时间氮气。
方案一:从定性观察角度判断
若B中无明显实验现象,D处气体能被点燃,则猜想①成立。
方案二:从定量计算角度判断
取一定量炭粉和4g氧化铜的混合物进行实验,并测定表格中的四个数据:
Ⅱ.若猜想②成立,则理论上(m4-m3) ____ (填“<”“=”或“>”)(m1-m2)。
Ⅲ.若猜想③成立且CuO全部转化成Cu,则参加反应的碳的质量m的取值范围是 ____ 。
(3)兔首和鼠首均为青铜器(铜、锡合金),表面呈绿色,这是铜器长期暴露在空气中生成了铜锈(铜锈俗称铜绿)。青铜器属于 ____ (填序号)。铜绿Cu2(OH)2CO3分解的化学方程式为 ____ 。
A.无机材料
B.合成材料
C.复合材料
D.复合肥
为了弄清铜生成铜绿的条件,某化学实验小组借鉴课本“铁钉锈蚀条件的探究”实验,设计了“铜片锈蚀条件的探究”实验,实验如图1所示(所用铜片洁净、光亮)。
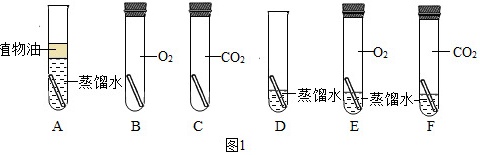
实验较长时间后,发现 ____ (填试管编号)试管中铜片最先生锈。小组讨论后发现实验还不够完善,要得出正确的结论,还要补充一个实验。你认为要补充的一个实验是:Cu和 ____ (写出试管中需要的物质)。可以省略不做的实验是试管 ____ (填试管编号)。
探究二、铜的制备研究
铜可采用如下方法制备:
方法一:火法炼铜:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2
方法二:湿法炼铜:CuSO4+Fe═FeSO4+Cu
(4)上述两种方法中,你认为哪种方法更好,原因是 ____ 。辉铜矿的主要成分为Cu2S,常用于火法炼铜。若生成过程中铜元素的转化率为90%,生产64t Cu需要含Cu2S 80%的辉铜矿 ____ t。(保留一位小数)
探究三、铜的化合物的制备研究
碱式碳酸铜可用于生产木材防腐剂等。工业上可用微蚀刻废液(含有一定量Cu2+、H+、SO42-、H2O2和微量Fe3+)制备高纯度碱式碳酸铜,其制备过程如图2:
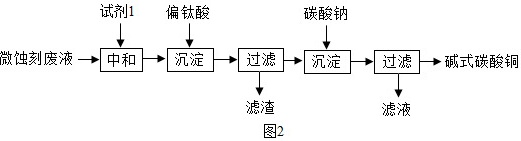
(5)加入试剂1的目的是除去废液中的酸性物质,试剂1最好选用 ____ (填序号)。
a.Fe2O3
b.CaCO3
c.CuO
(6)加入Na2CO3沉淀前须除去Fe3+,否则Fe2(SO4)3会与Na2CO3反应,产生一种气体,同时生成NaFe3(OH)6(SO4)2沉淀,影响产品质量,请写出反应的化学方程式 ____ 。
(7)加入Na2CO3沉淀时,反应液pH对产品中的SO42-含量以及反应液中Cu2+沉淀效率的影响如图3所示,第二次沉淀时溶液pH最好控制在 ____ 。
(8)所制得的碱式碳酸铜的组成可表示为:xCuCO3•yCu(OH)2•zH2O。某研究小组设计如图4实验装置测定其中CuCO3的质量分数(不考虑植物油中溶解CO2产生的影响)。
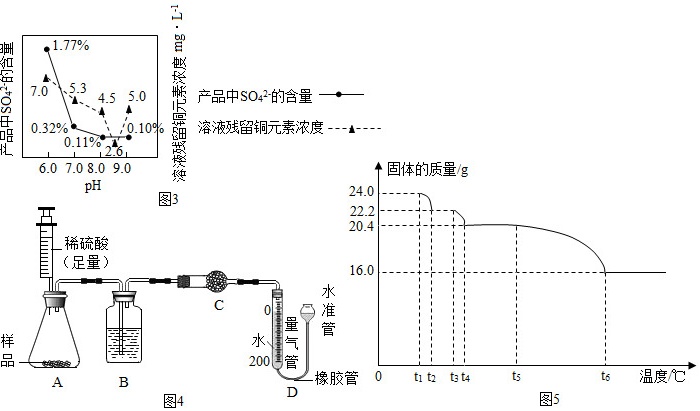
实验步骤如下:①连接装置并检验装置气密性;②准确称量样品的质量1.2g;③装药品,调节量气装置两边液面相平,读取量气管刻度为10mL;④向锥形瓶内加入50mL(足量)的稀硫酸,充分反应;⑤冷却到室温;⑥再次调节量气装置两边液面相平,读取量气管刻度为172mL。
Ⅰ.步骤一中检验装置气密性的方法是 ____ 。
Ⅱ.装置B的作用是 ____ ,C中的试剂是 ____ (填序号)。
a.碱石灰
b.浓硫酸
c.无水硫酸铜
Ⅲ.步骤⑥中调节液面相平的操作是 ____ 。
Ⅳ.若标准状况下,每44g二氧化碳的体积为22.4L。根据实验数据计算产品中CuCO3的质量分数(写出计算过程,保留到0.1%)。
计算过程:
Ⅴ.若其他操作均正确,仅因下列因素可使测定结果偏小的是 ____ (填序号)。
A.步骤③中平视刻度,步骤⑥中仰视读数
B.硫酸的用量不足
C.量气管中未加植物油D.步骤⑥中没有调节量气装置两边液面相平,直接读数
(9)碱式碳酸铜【xCuCO3•yCu(OH)2•zH2O】的热分解研究。小组同学用热分析仪对固体进行热分解,获得相关数据,绘成的固体质量与分解温度的关系如图5。(已知Cu(OH)2的分解温度小于CuCO3的分解温度。)
Ⅰ.通过计算可得x:y:z= ____ 。
Ⅱ.若将16.0g剩余固体继续加热到更高的温度,发现固体质量减少了1.6g后质量不再改变,写出此过程中可能发生反应的化学方程式: ____ 。
探究一、铜的性质及其应用
(1)化学小组用一定量AgNO3和Al(NO3)3的混合溶液加入铜粉和锌粉,充分反应后过滤,得到溶液甲和固体乙,下列说法正确的是 ____ (填序号)。
A.溶液甲中一定含有Al(NO3)3和Zn(NO3)2
B.固体乙中一定含有Ag,可能含有Cu和Zn
C.若溶液甲是蓝色,则溶液甲一定含有Al(NO3)3、Zn(NO3)2和Cu(NO3)2
D.向固体乙上滴加盐酸有气泡产生,则溶液甲中一定没有AgNO3和Cu(NO3)2
(2)碳还原氧化铜的实验装置如图甲、乙所示。

Ⅰ.甲图中酒精灯上网罩的作用是 ____ 。
[提出问题]碳燃烧时可能生成CO2也可能生成CO,那么碳与氧化铜反应生成的气体是否也有多种可能?
[作出猜想]猜想①:CO;猜想②:CO2;猜想③:CO和CO2。
[设计方案]实验装置如图乙。打开K,缓缓通入干燥的氮气一段时间,关闭K,点燃酒精喷灯和酒精灯,充分反应后,熄灭酒精喷灯和酒精灯,打开K,再通一段时间氮气。
方案一:从定性观察角度判断
若B中无明显实验现象,D处气体能被点燃,则猜想①成立。
方案二:从定量计算角度判断
取一定量炭粉和4g氧化铜的混合物进行实验,并测定表格中的四个数据:
| 反应前的质量 | 反应后的质量 | |
| A(玻璃管+固体) | m1 | m2 |
| B+C(广口瓶+混合液) | m3 | m4 |
Ⅲ.若猜想③成立且CuO全部转化成Cu,则参加反应的碳的质量m的取值范围是 ____ 。
(3)兔首和鼠首均为青铜器(铜、锡合金),表面呈绿色,这是铜器长期暴露在空气中生成了铜锈(铜锈俗称铜绿)。青铜器属于 ____ (填序号)。铜绿Cu2(OH)2CO3分解的化学方程式为 ____ 。
A.无机材料
B.合成材料
C.复合材料
D.复合肥
为了弄清铜生成铜绿的条件,某化学实验小组借鉴课本“铁钉锈蚀条件的探究”实验,设计了“铜片锈蚀条件的探究”实验,实验如图1所示(所用铜片洁净、光亮)。

实验较长时间后,发现 ____ (填试管编号)试管中铜片最先生锈。小组讨论后发现实验还不够完善,要得出正确的结论,还要补充一个实验。你认为要补充的一个实验是:Cu和 ____ (写出试管中需要的物质)。可以省略不做的实验是试管 ____ (填试管编号)。
探究二、铜的制备研究
铜可采用如下方法制备:
方法一:火法炼铜:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2
方法二:湿法炼铜:CuSO4+Fe═FeSO4+Cu
(4)上述两种方法中,你认为哪种方法更好,原因是 ____ 。辉铜矿的主要成分为Cu2S,常用于火法炼铜。若生成过程中铜元素的转化率为90%,生产64t Cu需要含Cu2S 80%的辉铜矿 ____ t。(保留一位小数)
探究三、铜的化合物的制备研究
碱式碳酸铜可用于生产木材防腐剂等。工业上可用微蚀刻废液(含有一定量Cu2+、H+、SO42-、H2O2和微量Fe3+)制备高纯度碱式碳酸铜,其制备过程如图2:

(5)加入试剂1的目的是除去废液中的酸性物质,试剂1最好选用 ____ (填序号)。
a.Fe2O3
b.CaCO3
c.CuO
(6)加入Na2CO3沉淀前须除去Fe3+,否则Fe2(SO4)3会与Na2CO3反应,产生一种气体,同时生成NaFe3(OH)6(SO4)2沉淀,影响产品质量,请写出反应的化学方程式 ____ 。
(7)加入Na2CO3沉淀时,反应液pH对产品中的SO42-含量以及反应液中Cu2+沉淀效率的影响如图3所示,第二次沉淀时溶液pH最好控制在 ____ 。
(8)所制得的碱式碳酸铜的组成可表示为:xCuCO3•yCu(OH)2•zH2O。某研究小组设计如图4实验装置测定其中CuCO3的质量分数(不考虑植物油中溶解CO2产生的影响)。

实验步骤如下:①连接装置并检验装置气密性;②准确称量样品的质量1.2g;③装药品,调节量气装置两边液面相平,读取量气管刻度为10mL;④向锥形瓶内加入50mL(足量)的稀硫酸,充分反应;⑤冷却到室温;⑥再次调节量气装置两边液面相平,读取量气管刻度为172mL。
Ⅰ.步骤一中检验装置气密性的方法是 ____ 。
Ⅱ.装置B的作用是 ____ ,C中的试剂是 ____ (填序号)。
a.碱石灰
b.浓硫酸
c.无水硫酸铜
Ⅲ.步骤⑥中调节液面相平的操作是 ____ 。
Ⅳ.若标准状况下,每44g二氧化碳的体积为22.4L。根据实验数据计算产品中CuCO3的质量分数(写出计算过程,保留到0.1%)。
计算过程:
Ⅴ.若其他操作均正确,仅因下列因素可使测定结果偏小的是 ____ (填序号)。
A.步骤③中平视刻度,步骤⑥中仰视读数
B.硫酸的用量不足
C.量气管中未加植物油D.步骤⑥中没有调节量气装置两边液面相平,直接读数
(9)碱式碳酸铜【xCuCO3•yCu(OH)2•zH2O】的热分解研究。小组同学用热分析仪对固体进行热分解,获得相关数据,绘成的固体质量与分解温度的关系如图5。(已知Cu(OH)2的分解温度小于CuCO3的分解温度。)
Ⅰ.通过计算可得x:y:z= ____ 。
Ⅱ.若将16.0g剩余固体继续加热到更高的温度,发现固体质量减少了1.6g后质量不再改变,写出此过程中可能发生反应的化学方程式: ____ 。
题目解答
答案
解:探究一、铜的性质及其应用
(1)A、金属活动性为Al>Zn>Cu>Ag,在硝酸银和硝酸铝的混合物中加入铜粉和锌粉,硝酸铝一定不反应,因此溶液一定存在硝酸铝,而锌与硝酸银一定可以反应生成硝酸锌和银,若硝酸银过量,则铜会与硝酸银反应生成硝酸铜和银,但是只要加入锌粉和铜粉,锌与硝酸银一定反应,此时溶液一定有硝酸锌,因此溶液甲一定存在硝酸铝和硝酸锌,选项A正确;
B、锌一定与硝酸银反应生成硝酸锌和银,固体中一定有银,而锌若足量,则锌有剩余,铜不参与反应,所以固体乙可能含有锌和铜,选项B正确;
C、溶液甲为蓝色,说明含有硝酸铜,因此锌全部反应完毕,铜参与反应,与硝酸银反应生成了硝酸铜和银,因此溶液甲一定存在硝酸铝、硝酸锌和硝酸铜,选项C正确;
D、固体乙加入稀盐酸有气泡产生,说明锌有剩余,因此硝酸银全部反应完毕,铜没有参与反应,因此溶液甲一定没有硝酸银和硝酸铜,选项D正确;
故选:ABCD;
(2)Ⅰ、碳与氧化铜反应需要高温,所以利用网罩聚集火焰,提高温度,利于反应进行;故填:集中火焰,提高温度;
【设计方案】Ⅱ、若猜想Ⅱ成立,说明气体中有二氧化碳,没有一氧化碳,B中足量的氢氧化钙溶液可以将二氧化碳全部吸收,因此要遵循质量守恒定律,而A中减少的质量为二氧化碳质量,而B和C中增加的质量则为生成的二氧化碳质量,所以都表示二氧化碳质量,两部分质量差应该相等,即(m4-m3)=(m1-m2);故填:=;
Ⅲ、当反应后只有一氧化碳,设此时需要炭粉质量为x,
C+CuO$\frac{\underline{\;高温\;}}{\;}$CO+Cu
12 80
x 4g
$\frac{12}{80}$=$\frac{x}{4g}$ x=0.6g
当反应后只有二氧化碳,设此时需要炭粉质量为y,
C+2CuO$\frac{\underline{\;高温\;}}{\;}$CO2+2Cu
12 160
y 4g
$\frac{12}{160}$=$\frac{y}{4g}$
y=0.3g,
猜想Ⅲ成立,说明气体为混合物,所以需要炭粉质量介于x和y之间,所以y<m<x,即0.3g<m<0.6g;
故填:0.3g<m<0.6g;
(3)兔首和鼠首均为青铜器(铜、锡合金),合金属于无机材料,所以青铜器属于无机材料;铜绿分解生成氧化铜、水和二氧化碳,反应的化学方程式为:Cu2(OH)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+H2O+CO2↑;实验较长时间后,由于D中接触水和空气,所以发现D试管中铜片最先生锈;小组讨论后发现实验还不够完善,要得出正确的结论,实验缺少了把铜片置于装有干燥空气(或氧气和二氧化碳)的试管中,所以要补充的一个实验是Cu和CO2、O2充分接触;从控制变量法的角度,可以省略不做的实验是试管ABC;故填:A;D;CO2、O2; Cu2(OH)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+H2O+CO2↑;ABC;
探究二、铜的制备研究
(4)上述两种方法中,更好的是方法二,原因是能耗低,不产生二氧化硫这种污染空气的气体等;
设需要含Cu2S 80%的辉铜矿质量为x,
根据题意有:x×80%×$\frac{128}{160}$×100%×90%=64t,
x=111.1t,
故填:方法二更好,能耗低,不产生二氧化硫这种污染空气的气体; 111.1;
探究三、铜的化合物的制备研究
(5)加入试剂1的目的是除去废液中的酸性物质,为避免带入新的杂质,试剂1最好选用含铜的化合物且能和酸反应,所以选择氧化铜;故选:c.
(6)根据质量守恒定律,反应的化学方程式为:6Na2CO3+3Fe2(SO4)3+6H2O=2NaFe3(OH)6(SO4)2+6CO2↑+5Na2SO4;故填:6Na2CO3+3Fe2(SO4)3+6H2O=2NaFe3(OH)6(SO4)2+6CO2↑+5Na2SO4;
(7)由图3所示可知,溶液pH为8.5左右时,硫酸根离子含量最低,溶液中铜离子沉淀效率最高,因此第二次沉淀时溶液pH最好控制在8.5;故填:8.5;
(8)Ⅰ、步骤一中检验装置气密性的方法是往里推注射器活塞,若装置B中的有气泡产生,D装置内量气管内液面下降,水准管液面上升,则该装置的气密性良好 故填:往里推注射器活塞,若装置B中的有气泡产生,D装置内量气管内液面下降,水准管液面上升,则该装置的气密性良好;
Ⅱ、装置B的作用是干燥二氧化碳,C中的试剂是无水硫酸铜,用来检验二氧化碳中是否含有水蒸气;故填:干燥二氧化碳;c;
Ⅲ、步骤⑥中调节液面相平的操作是将水用手紧握锥形瓶的外壁,若装置B中的有气泡产生,D装置内量气管内液面下降,则该装置的气密性良好准管缓慢下移;故填:将水准管缓慢下移;
Ⅳ、反应生成二氧化碳质量为:(172mL-50mL-10mL)÷1000÷22.4L×44g=0.22g,
设碳酸铜质量为y,
CuCO3+H2SO4═CuSO4+H2O+CO2↑,
124 44
y 0.22g
$\frac{124}{y}$=$\frac{44}{0.22g}$
y=0.62g,
产品中CuCO3的质量分数为:$\frac{0.62g}{1.2g}$×100%=51.7%,
答:产品中CuCO3的质量分数为51.7%.
Ⅴ、A、步骤③中平视刻度,步骤⑥中仰视读数所得二氧化碳的体积比实际大,会导致测定结果偏大;
B、硫酸的用量不足,碳酸铜未完全反应,生成二氧化碳减少,会导致测定结果偏小;
C、量气管中未加植物油,二氧化碳溶于水,导致二氧化碳体积偏小,会导致测定结果偏小;
D、步骤⑥中没有调节量气装置两边液面相平,量气管内压强大,液面高,导致二氧化碳体积减小,直接读数,会导致测定结果偏小.
故填:BCD;
(9)Ⅰ、加热时,结晶水先失去,因此结晶水的质量为:24.0g-22.2g=1.8g;
设氢氧化铜质量为z,
Cu(OH)2的分解温度小于CuCO3的分解温度,因此氢氧化铜完全反应后生成水的质量为:22.2g-20.4g=1.8g;
Cu(OH)2$\frac{\underline{\;高温\;}}{\;}$CuO+H2O,
98 18
z 1.8g
$\frac{98}{z}$=$\frac{18}{1.8g}$
z=9.8g,
设碳酸铜质量为m,
碳酸铜分解生成二氧化碳质量为:20.4g-16.0g=4.4g,
CuCO3$\frac{\underline{\;高温\;}}{\;}$CuO+CO2↑,
124 44
m 4.4g
$\frac{124}{m}$=$\frac{44}{4.4g}$
m=12.4g,
根据题意有:$\frac{12.4g}{124}$:$\frac{9.8g}{98}$=x:y,$\frac{9.8g}{98}$:$\frac{1.8g}{18}$=y:z,
通过计算可得:x:y:z=1:1:1;
故填:1:1:1;
Ⅱ、若将16.0g剩余固体继续加热到更高的温度,发现固体质量减少了1.6g后质量不再改变,说明反应过程中氧化铜中的氧元素一部分转化成氧气,剩余固体中铜元素质量为:16.0g××$\frac{64}{80}$100%=12.8g,
剩余固体中氧元素质量为:16.0g-12.8g-1.6g=1.6g,
设固体的化学式为CumOn,
根据题意有:64m:16n=12.8g:1.6g,
m:n=2:1,
因此剩余固体的化学式是Cu2O,
此过程中可能发生反应的化学方程式为:4CuO$\frac{\underline{\;高温\;}}{\;}$2Cu2O+O2↑.
故填:4CuO$\frac{\underline{\;高温\;}}{\;}$2Cu2O+O2↑。
(1)A、金属活动性为Al>Zn>Cu>Ag,在硝酸银和硝酸铝的混合物中加入铜粉和锌粉,硝酸铝一定不反应,因此溶液一定存在硝酸铝,而锌与硝酸银一定可以反应生成硝酸锌和银,若硝酸银过量,则铜会与硝酸银反应生成硝酸铜和银,但是只要加入锌粉和铜粉,锌与硝酸银一定反应,此时溶液一定有硝酸锌,因此溶液甲一定存在硝酸铝和硝酸锌,选项A正确;
B、锌一定与硝酸银反应生成硝酸锌和银,固体中一定有银,而锌若足量,则锌有剩余,铜不参与反应,所以固体乙可能含有锌和铜,选项B正确;
C、溶液甲为蓝色,说明含有硝酸铜,因此锌全部反应完毕,铜参与反应,与硝酸银反应生成了硝酸铜和银,因此溶液甲一定存在硝酸铝、硝酸锌和硝酸铜,选项C正确;
D、固体乙加入稀盐酸有气泡产生,说明锌有剩余,因此硝酸银全部反应完毕,铜没有参与反应,因此溶液甲一定没有硝酸银和硝酸铜,选项D正确;
故选:ABCD;
(2)Ⅰ、碳与氧化铜反应需要高温,所以利用网罩聚集火焰,提高温度,利于反应进行;故填:集中火焰,提高温度;
【设计方案】Ⅱ、若猜想Ⅱ成立,说明气体中有二氧化碳,没有一氧化碳,B中足量的氢氧化钙溶液可以将二氧化碳全部吸收,因此要遵循质量守恒定律,而A中减少的质量为二氧化碳质量,而B和C中增加的质量则为生成的二氧化碳质量,所以都表示二氧化碳质量,两部分质量差应该相等,即(m4-m3)=(m1-m2);故填:=;
Ⅲ、当反应后只有一氧化碳,设此时需要炭粉质量为x,
C+CuO$\frac{\underline{\;高温\;}}{\;}$CO+Cu
12 80
x 4g
$\frac{12}{80}$=$\frac{x}{4g}$ x=0.6g
当反应后只有二氧化碳,设此时需要炭粉质量为y,
C+2CuO$\frac{\underline{\;高温\;}}{\;}$CO2+2Cu
12 160
y 4g
$\frac{12}{160}$=$\frac{y}{4g}$
y=0.3g,
猜想Ⅲ成立,说明气体为混合物,所以需要炭粉质量介于x和y之间,所以y<m<x,即0.3g<m<0.6g;
故填:0.3g<m<0.6g;
(3)兔首和鼠首均为青铜器(铜、锡合金),合金属于无机材料,所以青铜器属于无机材料;铜绿分解生成氧化铜、水和二氧化碳,反应的化学方程式为:Cu2(OH)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+H2O+CO2↑;实验较长时间后,由于D中接触水和空气,所以发现D试管中铜片最先生锈;小组讨论后发现实验还不够完善,要得出正确的结论,实验缺少了把铜片置于装有干燥空气(或氧气和二氧化碳)的试管中,所以要补充的一个实验是Cu和CO2、O2充分接触;从控制变量法的角度,可以省略不做的实验是试管ABC;故填:A;D;CO2、O2; Cu2(OH)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+H2O+CO2↑;ABC;
探究二、铜的制备研究
(4)上述两种方法中,更好的是方法二,原因是能耗低,不产生二氧化硫这种污染空气的气体等;
设需要含Cu2S 80%的辉铜矿质量为x,
根据题意有:x×80%×$\frac{128}{160}$×100%×90%=64t,
x=111.1t,
故填:方法二更好,能耗低,不产生二氧化硫这种污染空气的气体; 111.1;
探究三、铜的化合物的制备研究
(5)加入试剂1的目的是除去废液中的酸性物质,为避免带入新的杂质,试剂1最好选用含铜的化合物且能和酸反应,所以选择氧化铜;故选:c.
(6)根据质量守恒定律,反应的化学方程式为:6Na2CO3+3Fe2(SO4)3+6H2O=2NaFe3(OH)6(SO4)2+6CO2↑+5Na2SO4;故填:6Na2CO3+3Fe2(SO4)3+6H2O=2NaFe3(OH)6(SO4)2+6CO2↑+5Na2SO4;
(7)由图3所示可知,溶液pH为8.5左右时,硫酸根离子含量最低,溶液中铜离子沉淀效率最高,因此第二次沉淀时溶液pH最好控制在8.5;故填:8.5;
(8)Ⅰ、步骤一中检验装置气密性的方法是往里推注射器活塞,若装置B中的有气泡产生,D装置内量气管内液面下降,水准管液面上升,则该装置的气密性良好 故填:往里推注射器活塞,若装置B中的有气泡产生,D装置内量气管内液面下降,水准管液面上升,则该装置的气密性良好;
Ⅱ、装置B的作用是干燥二氧化碳,C中的试剂是无水硫酸铜,用来检验二氧化碳中是否含有水蒸气;故填:干燥二氧化碳;c;
Ⅲ、步骤⑥中调节液面相平的操作是将水用手紧握锥形瓶的外壁,若装置B中的有气泡产生,D装置内量气管内液面下降,则该装置的气密性良好准管缓慢下移;故填:将水准管缓慢下移;
Ⅳ、反应生成二氧化碳质量为:(172mL-50mL-10mL)÷1000÷22.4L×44g=0.22g,
设碳酸铜质量为y,
CuCO3+H2SO4═CuSO4+H2O+CO2↑,
124 44
y 0.22g
$\frac{124}{y}$=$\frac{44}{0.22g}$
y=0.62g,
产品中CuCO3的质量分数为:$\frac{0.62g}{1.2g}$×100%=51.7%,
答:产品中CuCO3的质量分数为51.7%.
Ⅴ、A、步骤③中平视刻度,步骤⑥中仰视读数所得二氧化碳的体积比实际大,会导致测定结果偏大;
B、硫酸的用量不足,碳酸铜未完全反应,生成二氧化碳减少,会导致测定结果偏小;
C、量气管中未加植物油,二氧化碳溶于水,导致二氧化碳体积偏小,会导致测定结果偏小;
D、步骤⑥中没有调节量气装置两边液面相平,量气管内压强大,液面高,导致二氧化碳体积减小,直接读数,会导致测定结果偏小.
故填:BCD;
(9)Ⅰ、加热时,结晶水先失去,因此结晶水的质量为:24.0g-22.2g=1.8g;
设氢氧化铜质量为z,
Cu(OH)2的分解温度小于CuCO3的分解温度,因此氢氧化铜完全反应后生成水的质量为:22.2g-20.4g=1.8g;
Cu(OH)2$\frac{\underline{\;高温\;}}{\;}$CuO+H2O,
98 18
z 1.8g
$\frac{98}{z}$=$\frac{18}{1.8g}$
z=9.8g,
设碳酸铜质量为m,
碳酸铜分解生成二氧化碳质量为:20.4g-16.0g=4.4g,
CuCO3$\frac{\underline{\;高温\;}}{\;}$CuO+CO2↑,
124 44
m 4.4g
$\frac{124}{m}$=$\frac{44}{4.4g}$
m=12.4g,
根据题意有:$\frac{12.4g}{124}$:$\frac{9.8g}{98}$=x:y,$\frac{9.8g}{98}$:$\frac{1.8g}{18}$=y:z,
通过计算可得:x:y:z=1:1:1;
故填:1:1:1;
Ⅱ、若将16.0g剩余固体继续加热到更高的温度,发现固体质量减少了1.6g后质量不再改变,说明反应过程中氧化铜中的氧元素一部分转化成氧气,剩余固体中铜元素质量为:16.0g××$\frac{64}{80}$100%=12.8g,
剩余固体中氧元素质量为:16.0g-12.8g-1.6g=1.6g,
设固体的化学式为CumOn,
根据题意有:64m:16n=12.8g:1.6g,
m:n=2:1,
因此剩余固体的化学式是Cu2O,
此过程中可能发生反应的化学方程式为:4CuO$\frac{\underline{\;高温\;}}{\;}$2Cu2O+O2↑.
故填:4CuO$\frac{\underline{\;高温\;}}{\;}$2Cu2O+O2↑。