题目
反应 C(s) + CO2(g) 2CO(g) 在1773K时Kθ=2.1×103,1273K时Kθ=1.6×102,计算:(1)反应的ΔrHmθ,并说明是吸热反应还是放热反应;(2)计算1773K时反应的ΔrGmθ(3)计算反应的ΔrSmθ。
反应 C(s) + CO2(g)  2CO(g) 在1773K时Kθ=2.1×103,1273K时Kθ=1.6×102,计算:
2CO(g) 在1773K时Kθ=2.1×103,1273K时Kθ=1.6×102,计算:
(1)反应的ΔrHmθ,并说明是吸热反应还是放热反应;
(2)计算1773K时反应的ΔrGmθ
(3)计算反应的ΔrSmθ。
题目解答
答案
解:
(1) 由 ln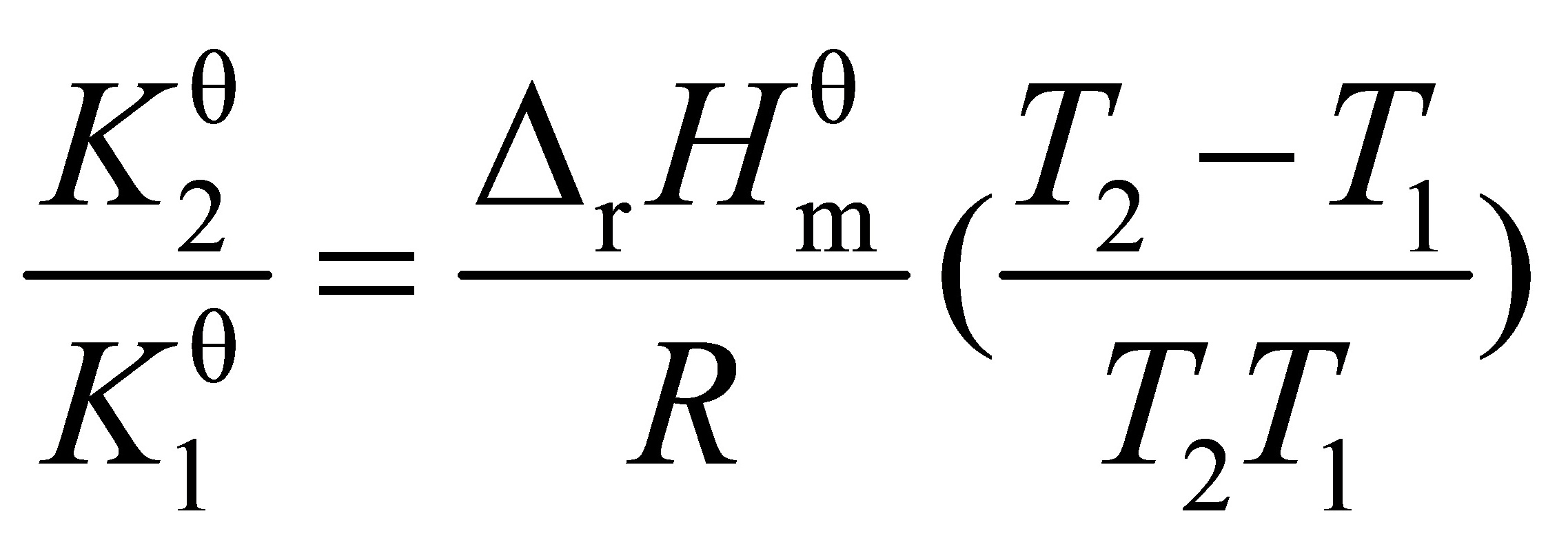
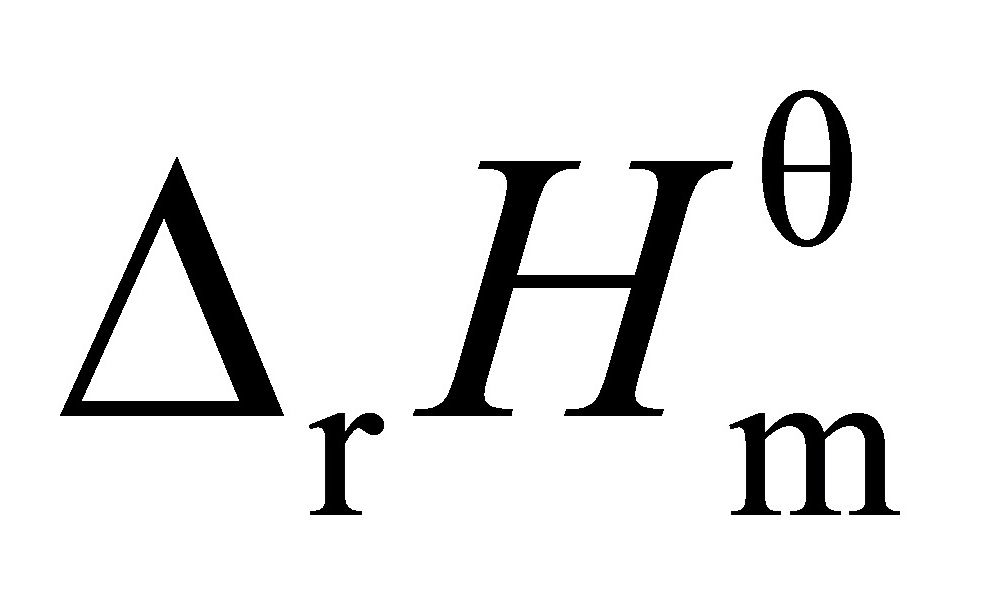 =
=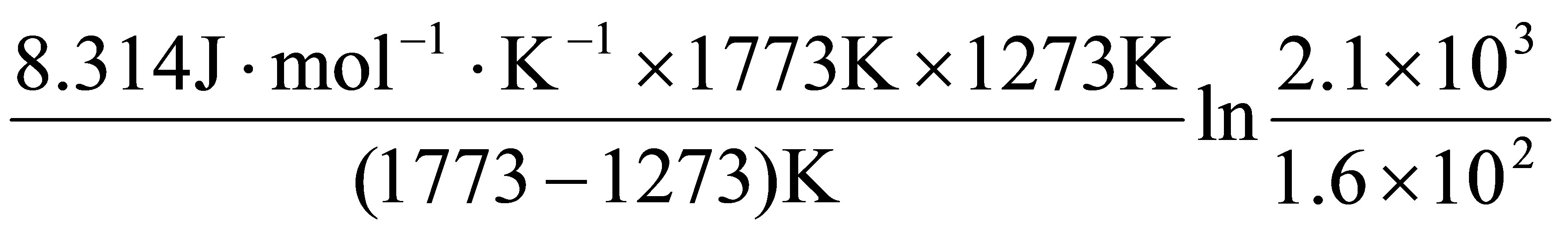 = 96.62 kJ·mol-1
= 96.62 kJ·mol-1
(2) 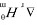 = -2.303RT lgKθ = -2.303×8.314
= -2.303RT lgKθ = -2.303×8.314 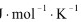 ×1773K×lg2100 = -112.78 kJ·mol-1
×1773K×lg2100 = -112.78 kJ·mol-1
(3) 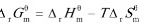
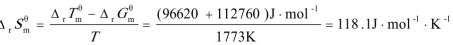
解析
步骤 1:计算反应的ΔrHmθ
根据范特霍夫方程,我们有:
$$\ln\left(\frac{K_2}{K_1}\right) = -\frac{\Delta_rH_m^\theta}{R}\left(\frac{1}{T_2} - \frac{1}{T_1}\right)$$
其中,$K_1$ 和 $K_2$ 分别是两个不同温度下的平衡常数,$T_1$ 和 $T_2$ 是对应的温度,$R$ 是理想气体常数,$\Delta_rH_m^\theta$ 是反应的摩尔焓变。将已知数据代入,可以求出 $\Delta_rH_m^\theta$。
步骤 2:计算1773K时反应的ΔrGmθ
根据吉布斯自由能变化公式,我们有:
$$\Delta_rG_m^\theta = -RT\ln K$$
其中,$R$ 是理想气体常数,$T$ 是温度,$K$ 是平衡常数。将已知数据代入,可以求出 $\Delta_rG_m^\theta$。
步骤 3:计算反应的ΔrSmθ
根据吉布斯自由能变化公式,我们有:
$$\Delta_rG_m^\theta = \Delta_rH_m^\theta - T\Delta_rS_m^\theta$$
其中,$\Delta_rH_m^\theta$ 是反应的摩尔焓变,$T$ 是温度,$\Delta_rS_m^\theta$ 是反应的摩尔熵变。将已知数据代入,可以求出 $\Delta_rS_m^\theta$。
根据范特霍夫方程,我们有:
$$\ln\left(\frac{K_2}{K_1}\right) = -\frac{\Delta_rH_m^\theta}{R}\left(\frac{1}{T_2} - \frac{1}{T_1}\right)$$
其中,$K_1$ 和 $K_2$ 分别是两个不同温度下的平衡常数,$T_1$ 和 $T_2$ 是对应的温度,$R$ 是理想气体常数,$\Delta_rH_m^\theta$ 是反应的摩尔焓变。将已知数据代入,可以求出 $\Delta_rH_m^\theta$。
步骤 2:计算1773K时反应的ΔrGmθ
根据吉布斯自由能变化公式,我们有:
$$\Delta_rG_m^\theta = -RT\ln K$$
其中,$R$ 是理想气体常数,$T$ 是温度,$K$ 是平衡常数。将已知数据代入,可以求出 $\Delta_rG_m^\theta$。
步骤 3:计算反应的ΔrSmθ
根据吉布斯自由能变化公式,我们有:
$$\Delta_rG_m^\theta = \Delta_rH_m^\theta - T\Delta_rS_m^\theta$$
其中,$\Delta_rH_m^\theta$ 是反应的摩尔焓变,$T$ 是温度,$\Delta_rS_m^\theta$ 是反应的摩尔熵变。将已知数据代入,可以求出 $\Delta_rS_m^\theta$。