题目
4.100g水中溶解1 gNH3,查得20℃时溶液上方NH3的平衡分压为798Pa。此稀溶液的气液相平衡-|||-关系服从亨利定律,试求亨利系数E(单位为kPa)、溶解度系数H[单位为 ((m)^3cdot kPa)] 和相平-|||-衡常数m。总压为100 kPa。

题目解答
答案
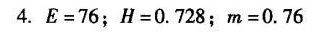
解析
步骤 1:计算亨利系数E
根据亨利定律,气体在溶液中的溶解度与该气体在气相中的分压成正比,即 $p = E \cdot x$,其中 $p$ 是气体的分压,$E$ 是亨利系数,$x$ 是气体在溶液中的摩尔分数。对于稀溶液,可以近似认为 $x = \frac{n_{NH3}}{n_{H2O} + n_{NH3}}$,其中 $n_{NH3}$ 和 $n_{H2O}$ 分别是氨和水的摩尔数。由于氨的量远小于水的量,可以近似认为 $x = \frac{n_{NH3}}{n_{H2O}}$。因此,$E = \frac{p}{x} = \frac{p \cdot n_{H2O}}{n_{NH3}}$。
步骤 2:计算溶解度系数H
溶解度系数H定义为在单位分压下,单位体积溶液中溶解的气体摩尔数,即 $H = \frac{n_{NH3}}{V \cdot p}$,其中 $V$ 是溶液的体积。由于水的密度约为1g/mL,100g水的体积约为0.1m³。因此,$H = \frac{n_{NH3}}{0.1 \cdot p}$。
步骤 3:计算相平衡常数m
相平衡常数m定义为气相中气体的摩尔分数与液相中气体的摩尔分数之比,即 $m = \frac{y_{NH3}}{x_{NH3}}$,其中 $y_{NH3}$ 是气相中氨的摩尔分数。由于总压为100kPa,氨的分压为798Pa,因此 $y_{NH3} = \frac{798}{100000}$。因此,$m = \frac{y_{NH3}}{x_{NH3}}$。
根据亨利定律,气体在溶液中的溶解度与该气体在气相中的分压成正比,即 $p = E \cdot x$,其中 $p$ 是气体的分压,$E$ 是亨利系数,$x$ 是气体在溶液中的摩尔分数。对于稀溶液,可以近似认为 $x = \frac{n_{NH3}}{n_{H2O} + n_{NH3}}$,其中 $n_{NH3}$ 和 $n_{H2O}$ 分别是氨和水的摩尔数。由于氨的量远小于水的量,可以近似认为 $x = \frac{n_{NH3}}{n_{H2O}}$。因此,$E = \frac{p}{x} = \frac{p \cdot n_{H2O}}{n_{NH3}}$。
步骤 2:计算溶解度系数H
溶解度系数H定义为在单位分压下,单位体积溶液中溶解的气体摩尔数,即 $H = \frac{n_{NH3}}{V \cdot p}$,其中 $V$ 是溶液的体积。由于水的密度约为1g/mL,100g水的体积约为0.1m³。因此,$H = \frac{n_{NH3}}{0.1 \cdot p}$。
步骤 3:计算相平衡常数m
相平衡常数m定义为气相中气体的摩尔分数与液相中气体的摩尔分数之比,即 $m = \frac{y_{NH3}}{x_{NH3}}$,其中 $y_{NH3}$ 是气相中氨的摩尔分数。由于总压为100kPa,氨的分压为798Pa,因此 $y_{NH3} = \frac{798}{100000}$。因此,$m = \frac{y_{NH3}}{x_{NH3}}$。