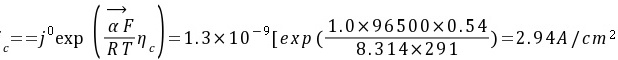题目
将一块锌板作为牺牲阳极安装在铜质船体上,该体系在海水中发生腐蚀时为锌溶解。若25℃时,反应Zn2+ + 2e Zn的交换电流密度为210-5 A/cm2,若传递系数=0.9,试求25℃,阳极极化值为0.05V时锌阳极溶解速度和极化电阻值。
将一块锌板作为牺牲阳极安装在铜质船体上,该体系在海水中发生腐蚀时为锌溶解。若25℃时,反应Zn2+ + 2e Zn的交换电流密度为210-5 A/cm2,若传递系数=0.9,试求25℃,阳极极化值为0.05V时锌阳极溶解速度和极化电阻值。
题目解答
答案
解:锌阳极溶解速度
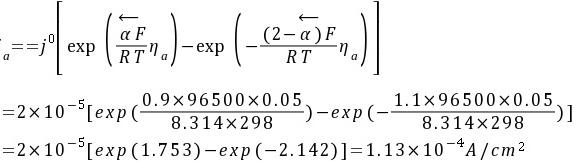
极化电阻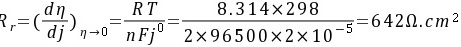
对ja~ηa方程两边微分得
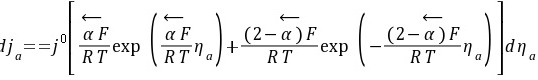
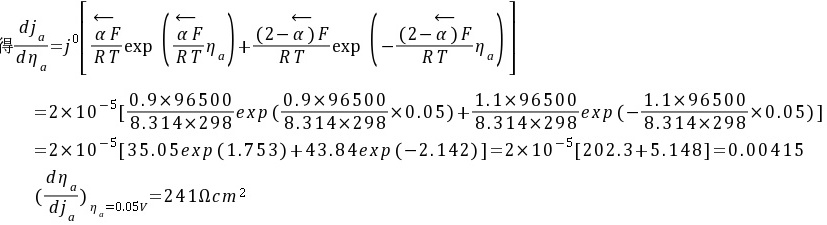
6.18℃时将铜棒浸入含CuSO4溶液中,测得该体系的平衡电位为0.31V,交换电流密度为1.310-9 A/cm2,传递系数=1.0。
(1)计算电解液中Cu2+离子在平衡电位下的活度。
(2)将电极电位极化到-0.23V时的极化电流密度(假定发生电化学极化)。
解:(1)已知Cu2+电极25℃时标准电位25℃=0.337V,(d/dT)=810-6V/K,则18℃时标准电位=0.337V+(18-25)(d/dT)=0.3369V
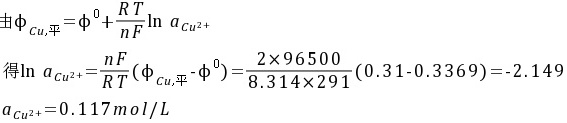
(2)过电位η=0.31-(-0.23)=0.54V