2.273.15K下1 mol 纯理想气体,压力由100kPa升高到500 kPa。求其吉布斯函数的变-|||-化值。
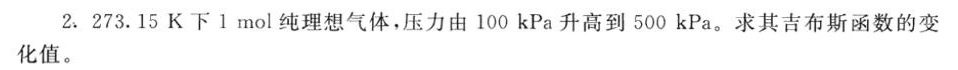
题目解答
答案
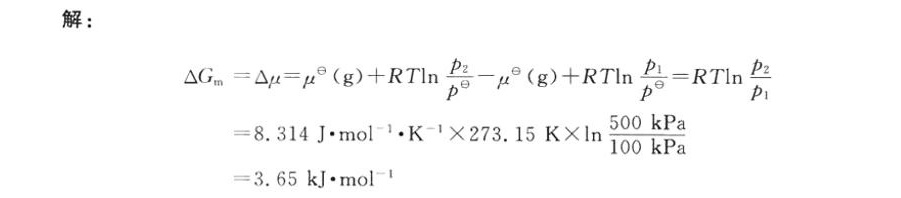
解析
本题考查理想气体吉布斯函数变化的计算,关键在于利用纯理想气体化学势的表达式推导吉布斯函数变的公式。
步骤1:明确吉布斯函数与化学势的关系
对于纯物质,摩尔吉布斯函数 $G_m = \mu$(化学势)。因此,1 mol理想气体的吉布斯函数变化 $\Delta G = \Delta \mu$。
步骤2:纯理想气体的化学势表达式
纯理想气体的化学势可表示为:
$\mu = \mu^\theta + RT\ln\left(\frac{p}{p^\theta}\right)$
其中:
- $\mu^\theta$ 为标准态化学势(压力 $p^\theta = 100\ \text{kPa}$ 时的吉布斯函数),
- $R = 8.314\ \text{J·mol}^{-1}\cdot\text{K}^{-1}$(气体常数),
- $T = 273.15\ \text{K}$(温度),
- $p$ 为气体压力。
步骤3:计算吉布斯函数变 $\Delta G$
初始状态($p_1 = 100\ \text{kPa}$)和终态($p_2 = 500\ \text{kPa}$)的化学势差为:
$\Delta \mu = \mu_2 - \mu_1 = \left(\mu^\theta + RT\ln\left(\frac{p_2}{p^\theta}\right)\right) - \left(\mu^\theta + RT\ln\left(\frac{p_1}{p^\theta}\right)\right)$
化简得:
$\Delta \mu = RT\ln\left(\frac{p_2}{p_1}\right)$
步骤4:代入数值计算
$\Delta G = 8.314\ \text{J·mol}^{-1}\cdot\text{K}^{-1} \times 273.15\ \text{K} \times \ln\left(\frac{500}{100}\right)$
$= 8.314 \times 273.15 \times \ln 5$
$\approx 8.314 \times 273.15 \times 1.6094 \approx 3650\ \text{J·mol}^{-1} = 3.65\ \text{kJ·mol}^{-1}$