题目
d区价电子,并不是只有少数s能级上有一个电子,很多不是半充满状态也是只有一个电子,所以我到底应该怎么确定d区s能级上几个电子呢 取射性元素-|||-Li 人造元素 5f^36d 7s^2 排布,括号-|||-4 Be 注×的是 铀-|||-铍 指可能的电子排布 13-|||-元素 金属元素 ⅢA IVA-|||-9.012 238.0 对原子质量(号的数 5 B 6(-|||-a 12Mg 据为该放射性元素半衰期最 过数不 稀有气体元素 础-|||-长同位素的质歪数-|||-镁 ⅢB IVB VB VIB VIIB 13 Al-|||-3s^2 10.81 12-|||-24.31 3 4 5 6 7 8 9 yīn-|||-I B ⅡB 铝-|||-10 11 12 26.98-|||-25 Mn 26 Fe 27 Co-|||-10 11 12 26.98-|||-钙 锐 钛 钒 铬-|||-21 Sc-|||-3d^44^2-|||-锐-|||-44.96-|||-22 Ti-|||-3d^24s^2-|||-钛-|||-47.87-|||-23-|||-3d^34s^2-|||-钒-|||-50.94-|||-24 Cr-|||-3d^54s^-|||-铬-|||-52.00-|||-25 Mn-|||-锰-|||-3d^54s^2-|||-54.94-|||-26 Fe-|||-铁-|||-3d^64s^2-|||-55.85-|||-27 Co-|||-钴-|||-3d^44s^2-|||-58.93-|||-28 Ni-|||-58.69-|||-29 Cu-|||-3d=4s^2-|||-铜-|||-63.55-|||-3d^34s^2 3d^54s^ 3d^54s^2 3d^64s^2 钴-|||-铁 28 Ni 29 Cu 30 Zn 31 Ga-|||-40.08 44.96 47.87 50.94-|||-30 Zn-|||-锌-|||-3d^(4)=4s^2-|||-65.38-|||-3d=4s^2 3d^(4)=4s^2 4824p^2-|||-39 Y 40 Zr 41 Nb 42 Mo 43 Tc-|||-58.93 58.69 63.55 65.38 69.72-|||-锐 错 妮 钼 得 钉 钝 46 Pd 47 Ag g 48 Cd 49 I-|||-4d^15s^2 4d^25s^2 4d^45s^-|||-钱 锐-|||-4d^15s^2-|||-62 88.91-|||-40 Zr-|||-错-|||-4d^25s^2-|||-91.22-|||-41 Nb-|||-妮-|||-4d^45s^-|||-92.91-|||-42 Mo-|||-钼-|||-4d^55s^1-|||-95.96-|||-43 Tc-|||-4d^55s^2-|||-得-|||-[98]-|||-44 Ru-|||-钉-|||-4d^75s^2-|||-101.1-|||-45 Rh-|||-钝-|||-4d^85s^2-|||-102.9-|||-46 Pd-|||-钯-|||-4d^10-|||-106.4-|||-银 钢-|||-4d^105s^2 4d^m^5s^2-|||-107.9 112.4 114-|||-57~71-|||-La~Lu-|||-镧系-|||-72Hf-|||-铅-|||-5d^26s^2-|||-178.5-|||-73 Ta-|||-但-|||-5d^36s^2-|||-180.9-|||-74 W-|||-钨-|||-5d^46s^2-|||-183.8-|||-75 Re-|||-锑-|||-5d^56s^2-|||-186.2-|||-76 Os-|||-锇-|||-5d^66^2-|||-190.2-|||-77 Ir 78 Pt-|||-几 La~Lu 铅 但 钨 锑 锇 铱 铂 金 汞-|||-6s^2 5d^26s^2 5d^36s^2 5d^46s^2 5d^56s^2 5d^66^2 5d^76s^2 5d^166^3 5d^106s^2-|||-79 Au-|||-金-|||-5d^166^3-|||-197.0-|||-镧系 178.5 180.9 183.8 186.2 190.2 192.2 195.1 197.0 200.6-|||-5d^26s^2 5d^36s^2 5d^46s^2 5d^56s^2 5d^66^2 5d^76s^2 5d^166^3 5d^106s^2-|||-89~103 104 Rf 105 Db 106 Sg 107 Bh 108 Hs 109 Mt|110 110 Ds 111 Rg 112 Cn-|||-钳× 6× 钟× 锂× 钱× 6× 轮× 每×-|||-钢系 (6d^27s^2) (6d^37s^2)-|||-104 Rf-|||-销×-|||-(6d^27s^2)-|||-[265 ]-|||-(6d^37s^2)-|||-[268] [271] 270] [277] [276] [281] 280] [285]-|||-CJ C.Th 66 Dv 67 H
d区价电子,并不是只有少数s能级上有一个电子,很多不是半充满状态也是只有一个电子,所以我到底应该怎么确定d区s能级上几个电子呢 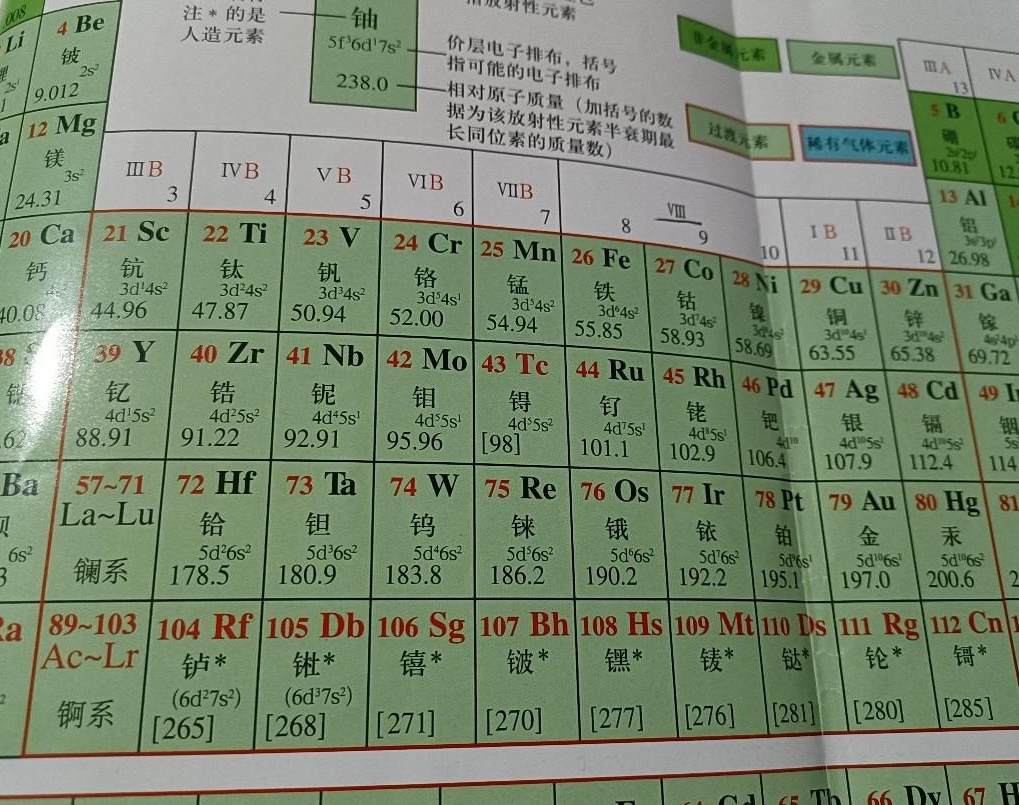

题目解答
答案

解析
考查要点:本题主要考查对d区元素电子排布规律的理解,特别是s能级电子数的确定。关键在于掌握构造量子数的填充顺序和原子与离子的电子排布差异。
解题核心思路:
- 明确d区元素的电子排布特点:d区元素的价电子包括(n-1)d轨道和ns轨道,其中s轨道的电子数通常为1或2。
- 区分原子与离子:原子的s轨道电子数由基态电子排布决定,而离子可能因失去电子导致s轨道电子数变化。
- 特殊排布规律:部分元素(如Cr、Cu)为追求半充满或全充满的稳定结构,会出现异常电子排布,此时s轨道电子数可能为1。
破题关键点:
- 基态原子的电子排布:遵循能量最低原理和洪德规则,优先填满d轨道后再填充s轨道。
- 异常排布的识别:如Cr的电子排布为$[Ar]3d^5 4s^1$,Cu为$[Ar]3d^{10} 4s^1$,此时s轨道仅有1个电子。
步骤1:确定元素所属区及价电子结构
- d区元素的价电子为$(n-1)d^m ns^k$,其中$k$通常为1或2。
- 基态原子的s轨道电子数由ns轨道的填充情况决定。
步骤2:分析特殊排布情况
- 半充满或全充满结构更稳定,例如:
- Cr:$[Ar]3d^5 4s^1$(3d半充满,4s仅1电子)。
- Cu:$[Ar]3d^{10} 4s^1$(3d全充满,4s仅1电子)。
步骤3:判断s轨道电子数
- 常规情况:s轨道电子数为2(如Ti:$[Ar]3d^2 4s^2$)。
- 异常情况:s轨道电子数为1(如Cr、Cu等)。