煤燃烧产生的烟气直接排放到空气中,引发的主要环境问题有温室效应、酸雨、粉尘污染等,针对以下脱硫方法解决相关问题。石灰石 - 石膏湿法。石灰石浆液在进入脱硫装置前,需通一段时间的二氧化碳,以增加其脱硫效率;脱硫时控制浆液的 (pH) 值,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化,生成硫酸钙。二氧化碳与石灰石浆液反应得到的产物为 (填化学式)。亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式 。氧化锌吸收法。配制 (ZnO) 悬浊液,在吸收塔中封闭循环脱硫,溶液中部分微粒与 (pH)(常温下)的关系如图 1 所示,测得 (pH) 值、吸收效率随时间 t 的变化如图 2 所示。1-|||-叫 i dfrac (c({HS{O)_(3)}^-)}(c(S{O)_(2))} dfrac (c({S{O)_(3)}^2-)}(c({S{O)_(2))}_(2)}-|||-0.8 F-|||-0.6-|||-0.5-|||-0.4 F c(H2SO3)-|||-0.2-|||-0-|||-2 4 6 7 8 10 pH 1-|||-叫 i dfrac (c({HS{O)_(3)}^-)}(c(S{O)_(2))} dfrac (c({S{O)_(3)}^2-)}(c({S{O)_(2))}_(2)}-|||-0.8 F-|||-0.6-|||-0.5-|||-0.4 F c(H2SO3)-|||-0.2-|||-0-|||-2 4 6 7 8 10 pH为提高 (S)(O)_2 的吸收效率,可采取的措施为 。(pH) = 7 时,溶液中 ((c({Z)(n)^2 + )})/((c({SO)_3^2 - ))} = 。钠碱循环法。(N)(a)_2(S)(O)_3 溶液作为吸收液,吸收 (S)(O)_2 的过程中,(pH) 值随 n((SO)_3^2 - ) sim n((HSO)_3^ - ) 的变化关系如下表所示。n((SO)_3^2 - ) sim n((HSO)_3^ - )91 sim 91 sim 19 sim 91(pH)8.27.26.2当吸收液的 (pH) 降至约为 6 时,需送至电解槽再生。再生示意图如图。1-|||-叫 i dfrac (c({HS{O)_(3)}^-)}(c(S{O)_(2))} dfrac (c({S{O)_(3)}^2-)}(c({S{O)_(2))}_(2)}-|||-0.8 F-|||-0.6-|||-0.5-|||-0.4 F c(H2SO3)-|||-0.2-|||-0-|||-2 4 6 7 8 10 pH上表判断 (NaHS)(O)_3 溶液显 性,用化学平衡原理解释 。(HSO)_3^ - 在阳极放电的电极反应式是 。当阴极室中溶液 (pH) 升至 8 以上时,吸收液再生并循环利用。简述再生原理: 。
煤燃烧产生的烟气直接排放到空气中,引发的主要环境问题有温室效应、酸雨、粉尘污染等,针对以下脱硫方法解决相关问题。
石灰石 $-$ 石膏湿法。石灰石浆液在进入脱硫装置前,需通一段时间的二氧化碳,以增加其脱硫效率;脱硫时控制浆液的 $\text{pH}$ 值,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化,生成硫酸钙。
二氧化碳与石灰石浆液反应得到的产物为 (填化学式)。
亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式 。
氧化锌吸收法。配制 $\text{ZnO}$ 悬浊液,在吸收塔中封闭循环脱硫,溶液中部分微粒与 $\text{pH}$(常温下)的关系如图 $1$ 所示,测得 $\text{pH}$ 值、吸收效率随时间 $t$ 的变化如图 $2$ 所示。
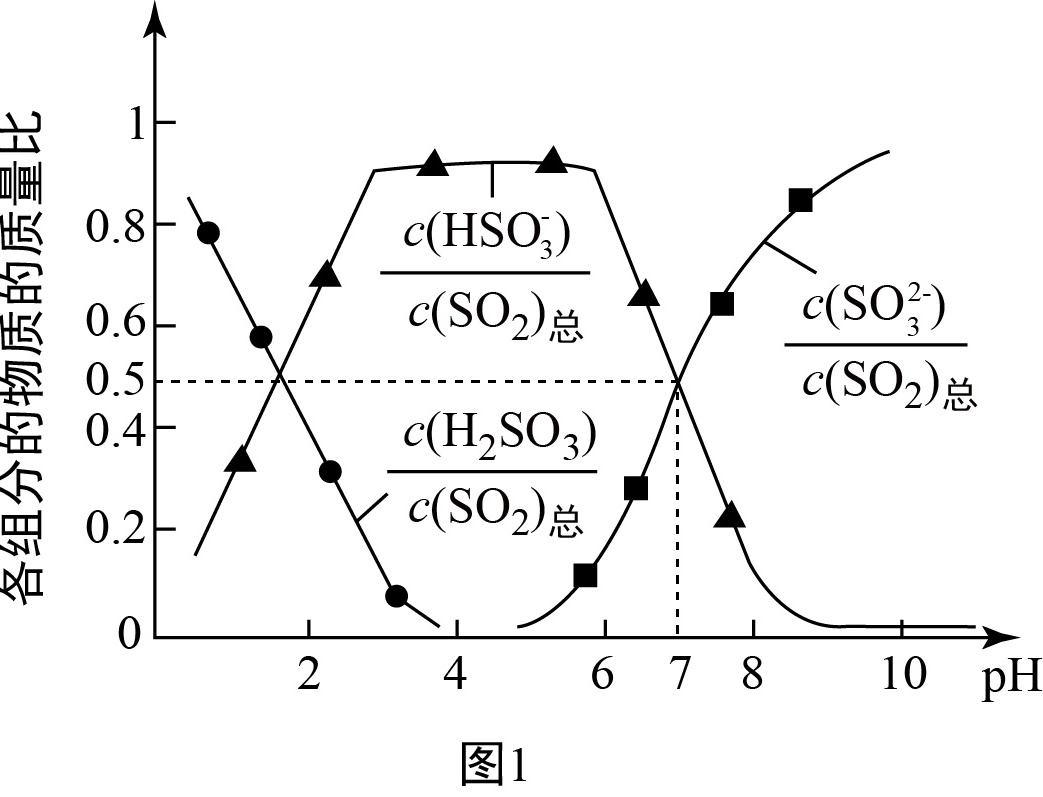
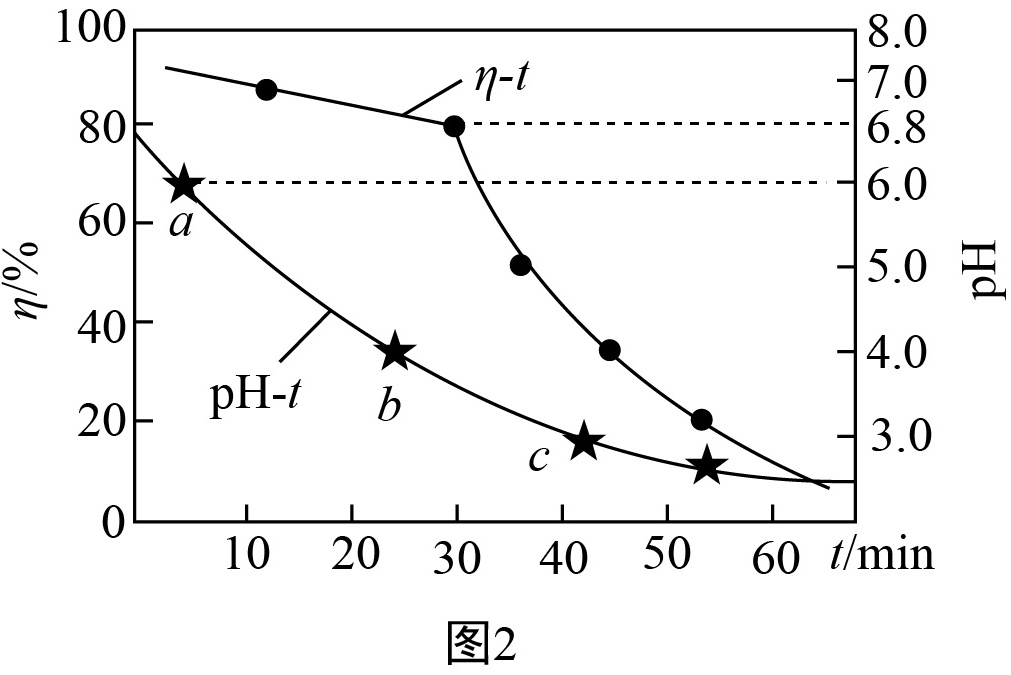
为提高 $\text{S}\text{O}_2$ 的吸收效率,可采取的措施为 。
$\text{pH} = 7$ 时,溶液中 $\frac {{c(\text{Z}\text{n}^{2 + })}}{{c(\text{SO}_3^{2 - })}} = $ 。
钠碱循环法。$\text{N}\text{a}_2\text{S}\text{O}_3$ 溶液作为吸收液,吸收 $\text{S}\text{O}_2$ 的过程中,$\text{pH}$ 值随 $n(\text{SO}_3^{2 - }) \sim n(\text{HSO}_3^ - )$ 的变化关系如下表所示。
| $n(\text{SO}_3^{2 - }) \sim n(\text{HSO}_3^ - )$ | $91 \sim 9$ | $1 \sim 1$ | $9 \sim 91$ |
| $\text{pH}$ | $8.2$ | $7.2$ | $6.2$ |
当吸收液的 $\text{pH}$ 降至约为 $6$ 时,需送至电解槽再生。再生示意图如图。
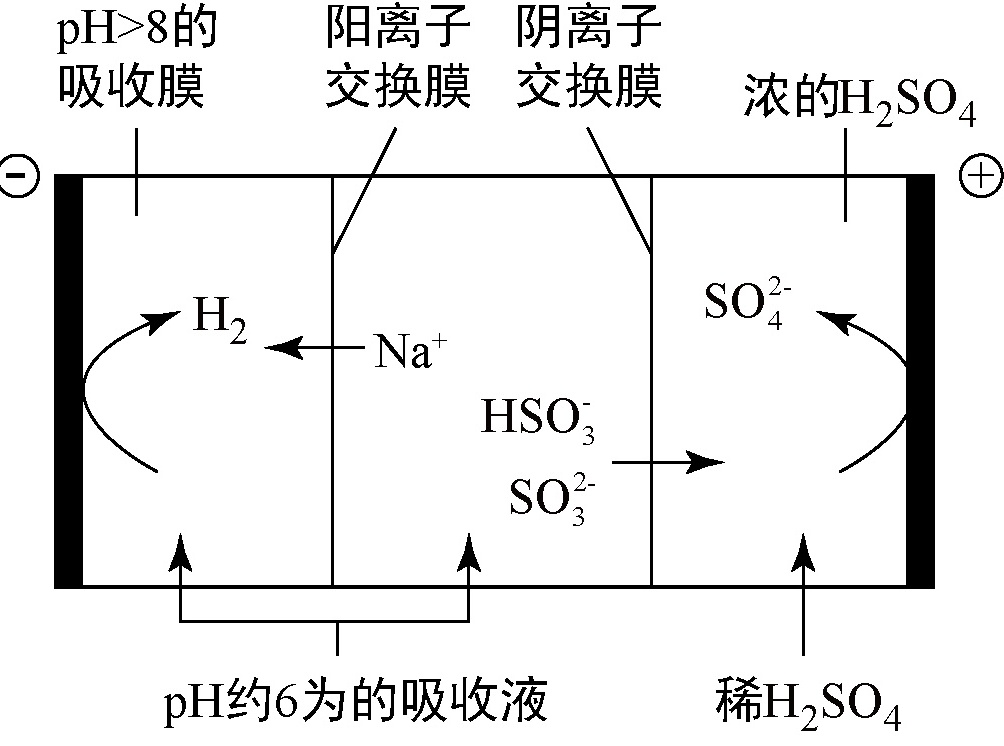
上表判断 $\text{NaHS}\text{O}_3$ 溶液显 性,用化学平衡原理解释 。
$\text{HSO}_3^ - $ 在阳极放电的电极反应式是 。
当阴极室中溶液 $\text{pH}$ 升至 $8$ 以上时,吸收液再生并循环利用。简述再生原理: 。
题目解答
答案
- (1)
- (1)$\rm Ca(HCO_3)_2 $
- (2)$\text{Ca(HS}\text{O}_3)_2 + \text{O}_2 = \text{CaS}\text{O}_4 + \text{H}_2\text{S}\text{O}_4$
- (2)
- (1)调节溶液的 $\text{pH}$ 至 $6.8$ 以上
- (2)$3:2$
- (3)
- (1)酸;$\text{HSO}_3^ - + \text{H}_2\text{O}\rightleftharpoons \text{O}\text{H}^ - + \text{H}_2\text{S}\text{O}_3$;$\text{HSO}_3^ - \rightleftharpoons \text{H}^ + + \text{SO}_3^{2 - }$
- (2)$\text{HSO}_3^ - + \text{H}_2\text{O} - 2\text{e}^ - = 3\text{H}^ + + \text{SO}_4^{2 - }$
- (3)在阴极室中,$\text{H}^ + $ 得电子生成 $\text{H}_2$,随着 $\text{H}^ + $ 浓度的降低,溶液 $\text{pH}$ 逐渐增大,可促使电离 $\text{HSO}_3^ - $ 生成 $\text{SO}_3^{2 - }$,且 $\text{N}\text{a}^ + $ 进入阴极室,吸收液得以再生