第六章 ⏺相平衡6-1 指出下列平衡系统中的组分数C,相数P及自由度数F:(1)I(s)与其蒸气成平衡;(2)CaCO2(s)与其分解产物CaO(s)和CO(g)成平衡;(3)NH3HS(s)放入一抽空的容器中,并与其分解产物NH2(g)和HS(g)成平衡;(4)取任意量的NH4(g)和H3S(g)与NH2HS(s)成平衡;(5) I3作为溶质在两不相互溶液体H2O和CCl4中达到分配平衡(凝聚系统)。解:(1) S-R-=1-0-0=1;P=2;F=C-P+2=1(2) S-R-=3-1-0=2;P=3;F=C-P+2=1(3) S-R-=3-1-1=1;P=2;F=C-P+2=1(4) S-R-=3-1-0=2;P=2;F=C-P+2=2(5) S-R-=3-0-0=3;P=2;F=C-P+1=26-2 已知液体甲苯(A)和液体苯(B)在90℃时的饱和蒸气压分别为和。两者可形成理想液态混合物。今有系统组成为的甲苯-苯混合物5 mol,在90℃下成气-液两相平衡,若气相组成为,求: (1)平衡时液相组成及系统的压力p;(2)平衡时气、液两相的物质的量n(g),n(l)。解:(1)理想液态混合物,A、B均适用拉乌尔定律,故有 (1) (2)由式(1)及式(2)得 (3) (4)联立式(3)与式(4),解得 ,(2)根据杠杆规则6-2 单组分系统硫的相图示意如下.试用相律分析相图中各点、线、面的相平衡关系及自由度数。解:对于单组分系统,根据相律F=C-P+2=3-P若P=1,则F=2,单相在图上表现为面,共有四个单相区,如图所示。若P=2,则F=1,两相平衡共存在图上表现为线,称为两相线,共有6条两相线,即:ax线表示正交硫与硫蒸气平衡共存;yb线表示正交硫与液体硫平衡共存;zc线表示液体硫与硫蒸气平衡共存;xy线表示正交硫与单斜硫平衡共存;xz线表示单斜硫与硫蒸气平衡共存;zy线表示单斜硫与液体硫平衡共存。还有三条两相亚稳态平衡线:Ox线是ax线的延长线,表示正交硫与硫蒸气平衡两相亚稳态共存;Oy线是yb线的延长线,表示正交硫与液体硫两相亚稳态平衡共存;Oz线是zc线的延长线,表示液体硫与硫蒸气两相亚稳态平衡共存;若P=3,则F=0,三相平衡共存在图表现为点,称为三相点,共有4个三相点,即:x点表示正交硫、单斜硫与硫蒸气平衡共存;z 点表示液体硫、单斜硫与硫蒸气平衡共存;y 点表示正交硫、单斜硫与液体硫平衡共存;O点表示正交硫、液体硫与硫蒸气平衡共存,不过O点平衡是不稳定平衡,会自发转变为稳定相—单斜硫。6-4 已知甲苯、苯在90℃下纯液体的饱和蒸气压分别为54.22kPa和136.12kPa。两者可形成理想液态混合物。取200.0g甲苯和200.0g苯置于带活塞的导热容器中,始态为一定压力下90℃的液态混合物。在恒温90℃下逐渐降低压力,问:(1)压力降到多少时,开始产生气相,此气相的组成如何?(2)压力降到多少时,液相开始消失,最后一滴液相的组成如何?(3)压力为92.00kPa时,系统内气、液两相平衡,两相组成如何?两相的物质的量各多少?解:(1)与开始产生气相平衡的液相,其组成同原始液态混合物,所以气相的压力为气相组成为 (2)与最后一滴液相平衡的气相,其组成同原始液态混合物上两式联立解得: (3) 原始液态混合物的组成为6-5 25℃丙醇(A)-水(B)系统气-液两相平衡时两组分蒸气分压与液相组成的关系如下:(1) 画出完整的压力-组成图(包栝蒸气分压及总压,液相线及气相线);(2)组成为x =0.3的系统在平衡压力p=4.16kPa下,气-液两相平衡,求平衡时气相组成y及液相组成x?(3)上述系统5mol,在p=4.16kPa下达到平衡时,气相、液相的物质的量各为多少?(4)上述系统10kg,在p=4.16kPa下达到平衡时,气相、液相的质量各为多少?解:(1)由题给数据计算出对应液相组成的气相总压及气相组成,计算结果列表如下:根据题给的及上述的数据,画出完整的压力-组成图,如下图所示。(2)从图可以查出 y=0.429,x =0.2(3) (4)M=60.096,M=18.015,y=0.429,x=0.2气相与液相的平均摩尔质量分别为上两式联立可得6-6 101.325kPa下水(A)-醋酸(B)系统的气-液平衡数据如下:(1)画出气-液平衡的温度-组成图;(2)从图上找出组成为x =0.800的液相的泡点;(3)从图上找出组成为yB =0.800的气相的露点;(4)105.0℃时气-液平衡两相组成是多少?(5)9kg水与30kg醋酸组成的系统在105.0℃达到平衡时,气、液两相的质量各为多少?解:(1)根据题给的数据,画出在101.325kPa下水(A)-醋酸(B)系统气-液平衡的温度-组成图,如下图所示。(2)由图查得x=0.800的液相的泡点为110.2℃。(3)由图查得yB=0.800的液相的露点为112.8℃。(4)由图查得105.0℃时气-液平衡两相的组成为xB=0.544, y=0.417。(5)MB=60.052,MB=18.015,y=0.417,x=544系统的总组成 系统总量 n=(30×10/60.052+9×10/18.015)mol=999.15mol根据杠杆规则6-7 已知水-苯酚系统在30℃液-液平衡时共轭溶液的组成w(苯酚)为:(苯酚溶于水),8.75%;(水溶于苯酚),69.9%。问:(1)在30℃、100g苯酚和200g水形成的系统达到液-液平衡时,两液相的质量各为多少?(2)在上述系统中再加入100g苯酚,又达到相平衡时,两液相的质量各为多少?解(1)系统总组成 根据杠杆规则:(2)系统总组成 根据杠杆规则:6-8 水-异丁醇系统液相部分互溶。在101.325kPa下,系统的共沸点为89.7℃。气(G)、液(L)、液(L)三相平衡时的组成w(异丁醇)依次为:70%、8.7%、85.0%。今由350g水和150g异丁醇形成的系统在标准压力下由室温加热,问:(1)温度刚要达到共沸点时,系统处于相平衡时存在那些相?其质量各为多少?(2)当温度由共沸点刚有上升趋势时,系统处于相平衡时存在那些相?其质量各为多少?解:系统总组成为:150/(150+350)=30%(1) 存在液(L)、液(L)二相平衡,根据杠杆规则,得(2)存在液(L)、液(L)二相平衡,根据杠杆规则,得6-9 恒压下二组分液态部分互溶系统气-液平衡的温度-组成图如附图(见教材p295),指出四个区域内平衡的相。解:四个区域内平衡的相如图中标注。6-10为了将含非挥发性杂质的甲苯提纯,在86.0kPa压力下用水蒸气蒸馏。已知:在此压力下该系统的共沸点为80℃,80℃时水的饱和蒸气压为47.3kPa。试求:(1)气相的组成(含甲苯的摩尔分数);(2)欲蒸出100kg纯甲苯,需要消耗蒸气多少?解:(1)y=p/p=(86.0-47.3)/86.0=0.450(2)6-11 液体HO(A)、CCl(B)的饱和蒸气压与温度的关系如下:两液体成完全不互溶系统。(1)绘出HO- CCl系统气、液、液三相平衡时气相中HO、CCl的蒸气分压及总压对温度的关系曲线;(2)从图中找出系统在外压101.325kPa下的共沸点;(3)某组成为y(含CCl的摩尔分数)的HO-CCl气体混合物在101.325kPa下泠却到80℃时,开始凝结出液体水,求此混合气体的组成;(4)上述气体混合物继续泠却至70℃时,气相组成如何?(5)上述气体混合物泠却到多少度时,CCl也凝结成液体,此时气相组成如何?解:(1)由题给数据计算出不同温度下的总压p=p2+p4,绘出蒸气压对温度的关系曲线如下图:(2)由图查得共沸点为66.75℃。(3)开始凝结出水,表明p =47.34kPa,所以混合气体的组成为(4)70℃时,p =31.16kPa,所以(5)根据题意,气、液、液三相平衡共存,惟有在共沸点下,所以t=66.75℃。此时气相组成为: 6-12 A-B二组分液态部分互溶系统的液-固平衡相图如附图(见教材P296),试指出各个相区的相平衡关系,各条线所代表的意义,以及三相线所代表的相平衡关系。解:该图各个相区的相平衡关系如下图所标注。mb线表示A(s)与L两相平衡共存;bd线表示B(s)与L两相平衡共存;dLe线表示L与L两液相平衡共存;ef线表示B(s)与L两相平衡共存。有两条三相线,即:abc线表示A(s)、B(s)及液相L三相平衡共存,def线表示B(s)、液相L及液相L三相平衡共存。有三个三相点即b、d、e点。6-13 固态完全互溶、具有最高熔点的A-B二组分凝聚系统相图如附图(见教材p297)。指出各相区的相平衡关系、各条线的意义,并绘出状态点为a、b的样品的泠却曲线。解:各相区的相平衡关系及状态点为a、b的样品的泠却曲线如图所标注。HN那条线为液相线(液态熔体与固态熔体平衡线),而下方那条线为固相线(固熔体与液体熔体平衡线)。同理,NO那条线为液相线(液态熔体与固态熔体平衡线),而下方那条线为固相线(固熔体与液体熔体平衡线)。6-14 低温时固态部分互溶、高温时固态完全互溶且具有最低熔点的A-B二组分凝聚系统相图如附图(见教材p385)。指出各相区的相平衡关系、各条线代表意义。解:各相区的相平衡关系如图所注。HIK线是固熔体S与固熔体S的两相平衡共存线,POQ那条线为液相线(液态熔体与固态熔体平衡线),而下方那条线为固相线(固熔体与液体熔体平衡线)。 6-15 二元凝聚系统Hg-Cd相图示意如附图(见教材p297)。指出各个相区的稳定相,三相线上的相平衡关系。解:各个相区的稳定相如图中标注。两条三相线上的相平衡关系如下:
第六章 ⏺相平衡
6-1 指出下列平衡系统中的组分数C,相数P及自由度数F:
(1)I(s)与其蒸气成平衡;
(2)CaCO2(s)与其分解产物CaO(s)和CO(g)成平衡;
(3)NH3HS(s)放入一抽空的容器中,并与其分解产物NH2(g)和HS(g)成平衡;
(4)取任意量的NH4(g)和H3S(g)与NH2HS(s)成平衡;
(5) I3作为溶质在两不相互溶液体H2O和CCl4中达到分配平衡(凝聚系统)。
解:(1) S-R-=1-0-0=1;P=2;F=C-P+2=1
(2) S-R-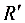 =3-1-0=2;P=3;F=C-P+2=1
=3-1-0=2;P=3;F=C-P+2=1
(3) S-R-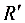 =3-1-1=1;P=2;F=C-P+2=1
=3-1-1=1;P=2;F=C-P+2=1
(4) S-R-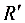 =3-1-0=2;P=2;F=C-P+2=2
=3-1-0=2;P=2;F=C-P+2=2
(5) S-R-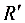 =3-0-0=3;P=2;F=C-P+1=2
=3-0-0=3;P=2;F=C-P+1=2
6-2 已知液体甲苯(A)和液体苯(B)在90℃时的饱和蒸气压分别为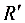 和。两者可形成理想液态混合物。今有系统组成为的甲苯-苯混合物5 mol,在90℃下成气-液两相平衡,若气相组成为,求: (1)平衡时液相组成及系统的压力p;(2)平衡时气、液两相的物质的量n(g),n(l)。
和。两者可形成理想液态混合物。今有系统组成为的甲苯-苯混合物5 mol,在90℃下成气-液两相平衡,若气相组成为,求: (1)平衡时液相组成及系统的压力p;(2)平衡时气、液两相的物质的量n(g),n(l)。
解:(1)理想液态混合物,A、B均适用拉乌尔定律,故有
(1)
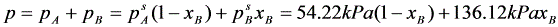 (2)
(2)
由式(1)及式(2)得
(3)
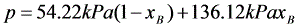 (4)
(4)
联立式(3)与式(4),解得 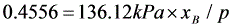 ,
,
(2)根据杠杆规则
6-2 单组分系统硫的相图示意如下.
试用相律分析相图中各点、线、面的相平衡关系及自由度数。
解:对于单组分系统,根据相律
F=C-P+2=3-P
若P=1,则F=2,单相在图上表现为面,共有四个单相区,如图所示。
若P=2,则F=1,两相平衡共存在图上表现为线,称为两相线,共有6条两相线,即:ax线表示正交硫与硫蒸气平衡共存;yb线表示正交硫与液体硫平衡共存;zc线表示液体硫与硫蒸气平衡共存;xy线表示正交硫与单斜硫平衡共存;xz线表示单斜硫与硫蒸气平衡共存;zy线表示单斜硫与液体硫平衡共存。还有三条两相亚稳态平衡线:Ox线是ax线的延长线,表示正交硫与硫蒸气平衡两相亚稳态共存;Oy线是yb线的延长线,表示正交硫与液体硫两相亚稳态平衡共存;Oz线是zc线的延长线,表示液体硫与硫蒸气两相亚稳态平衡共存;
若P=3,则F=0,三相平衡共存在图表现为点,称为三相点,共有4个三相点,即:x点表示正交硫、单斜硫与硫蒸气平衡共存;z 点表示液体硫、单斜硫与硫蒸气平衡共存;y 点表示正交硫、单斜硫与液体硫平衡共存;O点表示正交硫、液体硫与硫蒸气平衡共存,不过O点平衡是不稳定平衡,会自发转变为稳定相—单斜硫。
6-4 已知甲苯、苯在90℃下纯液体的饱和蒸气压分别为54.22kPa和136.12kPa。两者可形成理想液态混合物。
取200.0g甲苯和200.0g苯置于带活塞的导热容器中,始态为一定压力下90℃的液态混合物。在恒温90℃下逐渐降低压力,问:(1)压力降到多少时,开始产生气相,此气相的组成如何?(2)压力降到多少时,液相开始消失,最后一滴液相的组成如何?(3)压力为92.00kPa时,系统内气、液两相平衡,两相组成如何?两相的物质的量各多少?
解:(1)与开始产生气相平衡的液相,其组成同原始液态混合物,所以气相的压力为
气相组成为 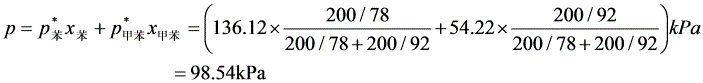
(2)与最后一滴液相平衡的气相,其组成同原始液态混合物
上两式联立解得: 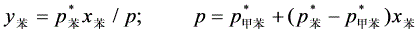
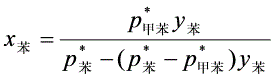
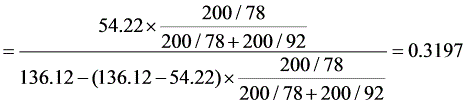
(3) 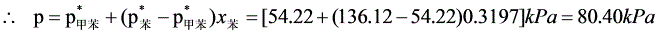
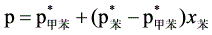
原始液态混合物的组成为
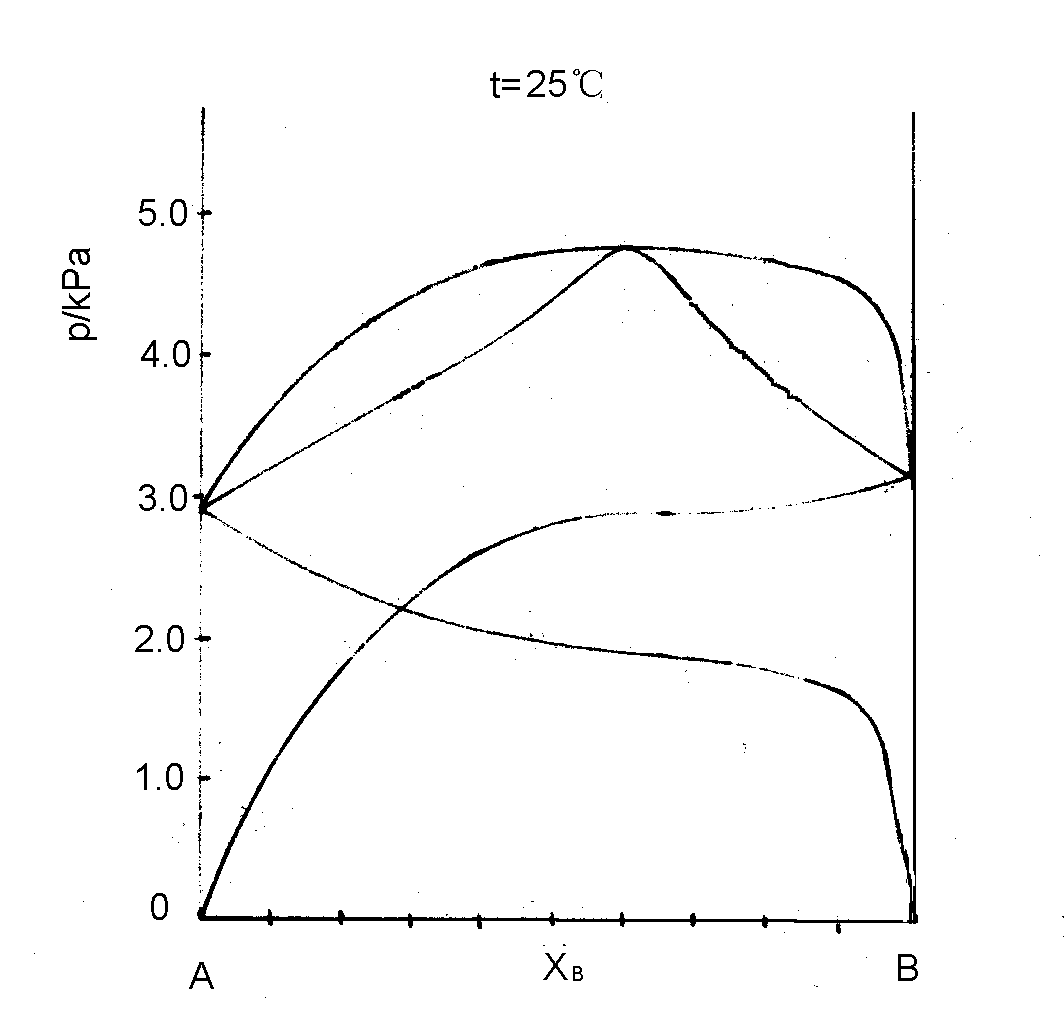
6-5 25℃丙醇(A)-水(B)系统气-液两相平衡时两组分蒸气分压与液相组成的关系如下:
(1) 画出完整的压力-组成图(包栝蒸气分压及总压,液相线及气相线);
(2)组成为x =0.3的系统在平衡压力p=4.16kPa下,气-液两相平衡,求平衡时气相组成y及液相组成x?
(3)上述系统5mol,在p=4.16kPa下达到平衡时,气相、液相的物质的量各为多少?
(4)上述系统10kg,在p=4.16kPa下达到平衡时,气相、液相的质量各为多少?
解:(1)由题给数据计算出对应液相组成的气相总压及气相组成,计算结果列表如下:
根据题给的及上述的数据,画出完整的压力-组成图,如下图所示。
(2)从图可以查出 y=0.429,x =0.2
(3)
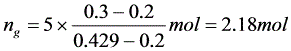
(4)M=60.096,M=18.015,y=0.429,x=0.2
气相与液相的平均摩尔质量分别为
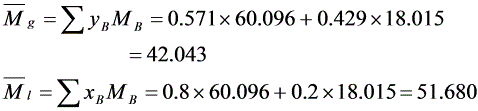
上两式联立可得
6-6 101.325kPa下水(A)-醋酸(B)系统的气-液平衡数据如下:
(1)画出气-液平衡的温度-组成图;(2)从图上找出组成为x =0.800的液相的泡点;
(3)从图上找出组成为yB =0.800的气相的露点;(4)105.0℃时气-液平衡两相组成是多少?
(5)9kg水与30kg醋酸组成的系统在105.0℃达到平衡时,气、液两相的质量各为多少?
解:(1)根据题给的数据,画出在101.325kPa下水(A)-醋酸(B)系统气-液平衡的温度-组成图,如下图所示。
(2)由图查得x=0.800的液相的泡点为110.2℃。
(3)由图查得yB=0.800的液相的露点为112.8℃。
(4)由图查得105.0℃时气-液平衡两相的组成为xB=0.544, y=0.417。
(5)MB=60.052,MB=18.015,y=0.417,x=544
系统的总组成
系统总量 n=(30×10/60.052+9×10/18.015)mol=999.15mol
根据杠杆规则
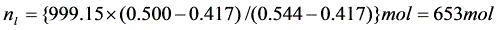
6-7 已知水-苯酚系统在30℃液-液平衡时共轭溶液的组成w(苯酚)为: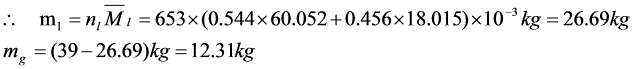 (苯酚溶于水),8.75%;(水溶于苯酚),69.9%。问:(1)在30℃、100g苯酚和200g水形成的系统达到液-液平衡时,两液相的质量各为多少?(2)在上述系统中再加入100g苯酚,又达到相平衡时,两液相的质量各为多少?
(苯酚溶于水),8.75%;(水溶于苯酚),69.9%。问:(1)在30℃、100g苯酚和200g水形成的系统达到液-液平衡时,两液相的质量各为多少?(2)在上述系统中再加入100g苯酚,又达到相平衡时,两液相的质量各为多少?
解(1)系统总组成 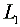
根据杠杆规则: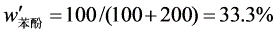
(2)系统总组成 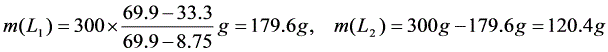
根据杠杆规则: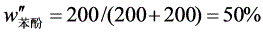
6-8 水-异丁醇系统液相部分互溶。在101.325kPa下,系统的共沸点为89.7℃。气(G)、液(L)、液(L)三相平衡时的组成w(异丁醇)依次为:70%、8.7%、85.0%。今由350g水和150g异丁醇形成的系统在标准压力下由室温加热,问:(1)温度刚要达到共沸点时,系统处于相平衡时存在那些相?其质量各为多少?(2)当温度由共沸点刚有上升趋势时,系统处于相平衡时存在那些相?其质量各为多少?
解:系统总组成为:150/(150+350)=30%
(1) 存在液(L)、液(L)二相平衡,根据杠杆规则,得
(2)存在液(L)、液(L)二相平衡,根据杠杆规则,得
6-9 恒压下二组分液态部分互溶系统气-液平衡的温度-组成图如附图(见教材p295),指出四个区域内平衡的相。
解:四个区域内平衡的相如图中标注。
6-10为了将含非挥发性杂质的甲苯提纯,在86.0kPa压力下用水蒸气蒸馏。已知:在此压力下该系统的共沸点为80℃,80℃时水的饱和蒸气压为47.3kPa。试求:(1)气相的组成(含甲苯的摩尔分数);(2)欲蒸出100kg纯甲苯,需要消耗蒸气多少?
解:(1)y=p/p=(86.0-47.3)/86.0=0.450
(2)
6-11 液体HO(A)、CCl(B)的饱和蒸气压与温度的关系如下:
两液体成完全不互溶系统。(1)绘出HO- CCl系统气、液、液三相平衡时气相中HO、CCl的蒸气分压及总压对温度的关系曲线;(2)从图中找出系统在外压101.325kPa下的共沸点;(3)某组成为y(含CCl的摩尔分数)的HO-CCl气体混合物在101.325kPa下泠却到80℃时,开始凝结出液体水,求此混合气体的组成;(4)上述气体混合物继续泠却至70℃时,气相组成如何?(5)上述气体混合物泠却到多少度时,CCl也凝结成液体,此时气相组成如何?
解:(1)由题给数据计算出不同温度下的总压p=p2+p4,绘出蒸气压对温度的关系曲线如下图:
(2)由图查得共沸点为66.75℃。
(3)开始凝结出水,表明p =47.34kPa,所以混合气体的组成为
(4)70℃时,p =31.16kPa,所以
(5)根据题意,气、液、液三相平衡共存,惟有在共沸点下,所以t=66.75℃。此时气相组成为: 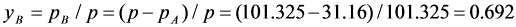
6-12 A-B二组分液态部分互溶系统的液-固平衡相图如附图(见教材P296),试指出各个相区的相平衡关系,各条线所代表的意义,以及三相线所代表的相平衡关系。
解:该图各个相区的相平衡关系如下图所标注。
mb线表示A(s)与L两相平衡共存;bd线表示B(s)与L两相平衡共存;dLe线表示L与L两液相平衡共存;ef线表示B(s)与L两相平衡共存。有两条三相线,即:abc线表示A(s)、B(s)及液相L三相平衡共存,def线表示B(s)、液相L及液相L三相平衡共存。有三个三相点即b、d、e点。
6-13 固态完全互溶、具有最高熔点的A-B二组分凝聚系统相图如附图(见教材p297)。指出各相区的相平衡关系、各条线的意义,并绘出状态点为a、b的样品的泠却曲线。
解:各相区的相平衡关系及状态点为a、b的样品的泠却曲线如图所标注。HN那条线为液相线(液态熔体与固态熔体平衡线),而下方那条线为固相线(固熔体与液体熔体平衡线)。同理,NO那条线为液相线(液态熔体与固态熔体平衡线),而下方那条线为固相线(固熔体与液体熔体平衡线)。
6-14 低温时固态部分互溶、高温时固态完全互溶且具有最低熔点的A-B二组分凝聚系统相图如附图(见教材p385)。指出各相区的相平衡关系、各条线代表意义。
解:各相区的相平衡关系如图所注。HIK线是固熔体S与固熔体S的两相平衡共存线,POQ那条线为液相线(液态熔体与固态熔体平衡线),而下方那条线为固相线(固熔体与液体熔体平衡线)。
6-15 二元凝聚系统Hg-Cd相图示意如附图(见教材p297)。指出各个相区的稳定相,三相线上的相平衡关系。
解:各个相区的稳定相如图中标注。两条三相线上的相平衡关系如下:
题目解答
答案
2-17 今有温度分别为 80 ℃、 40 ℃及 10 ℃的三种不同的固体物质 A 、 B 及 C 。若在与环境绝热条件下,等质量的 A 和 B 接触,热平衡后的温度为 57 ℃;等质量的 A 与 C 接触,热平衡后的温度为 36 ℃。若将等质量的 B 、 C 接触,达平衡后系统的温度应为多少? 解:设 A 、 B 、 C 的热容各为 c A 、 c B 、 c C ,于是有 mc A ( 57-80 ) +m c B ( 57-40 ) =0 ( 1 ) mc A ( 36-80 ) + mc C ( 36-10 ) =0 ( 2 ) mc B ( t-40 ) +m c C ( t-10 ) =0 ( 3 ) 得: c A ( 57-80 ) = - c B ( 57-40 ) ( 4 ) c A ( 36-80 ) = - c C ( 36-10 ) ( 5 ) c B ( t-40 ) + c C ( t-10 ) =0 ( 6 )