在操作条件25℃、压力101.3kPa下,用CO2含量为0.0001(摩尔分数)的水溶液与含CO210%(体积分数)的CO2-空气混合气在一容器充分接触,试:(1)判断CO2的传质方向, 且用气相摩尔分数表示过程的推动力;(2))若压力增加到506.5kPa,CO2的传质方向如何,并用液相分数表示过程的推动力。
在操作条件25℃、压力101.3kPa下,用CO2含量为0.0001(摩尔分数)的水溶液与含CO210%(体积分数)的CO2-空气混合气在一容器充分接触,试:
(1)判断CO2的传质方向, 且用气相摩尔分数表示过程的推动力;
(2))若压力增加到506.5kPa,CO2的传质方向如何,并用液相分数表示过程的推动力。
题目解答
答案
解:
(1)查得25℃、101.3kPa下CO2-水系统的E=166MPa
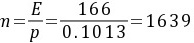
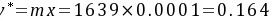
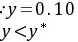
所以CO2的传质方向由液相向气相传递,解吸过程。
解吸过程的推动力为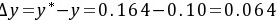
(2)压力增加到506.5kPa时,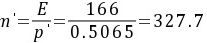
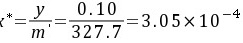
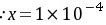
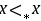
所以CO2的传质方向由气相向液相传递,吸收过程。
吸收过程的推动力为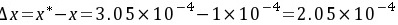
由上述计算结果可以看出:当压力不太高时,提高操作压力,由于相平衡常数显著地提高,导致溶质在液相中的溶解度增加,故有利于吸收。
扩散与单相传质
解析
考查要点:本题主要考查气体在液体中的溶解度及传质方向的判断,涉及亨利定律的应用和相平衡推动力的计算。
解题核心思路:
- 判断传质方向:比较气相实际浓度($y$)与液相平衡浓度($y^*$)或液相实际浓度($x$)与气相平衡浓度($x^*$),确定溶质传递方向。
- 计算推动力:根据相平衡关系,用实际浓度与平衡浓度的差值表示推动力。
- 压力影响:压力变化会改变相平衡常数($n = E/p$),从而影响溶解度和传质方向。
破题关键点:
- 正确应用亨利定律:$y = n x$ 或 $x = \frac{y}{m}$($m = n$)。
- 区分不同压力下的相平衡表达式:低压力时用气相推动力,高压力时用液相推动力。
第(1)题
计算相平衡常数$n$
$n = \frac{E}{p} = \frac{166}{0.1013} \approx 1639$
计算液相平衡对应的气相浓度$y^*$
$y^* = n x = 1639 \times 0.0001 = 0.164$
比较实际气相浓度$y$与$y^*$
实际气相浓度$y = 0.10$,因$y < y^*$,说明气相实际浓度低于平衡浓度,CO₂从液相向气相传递(解吸过程)。
推动力计算
$\text{推动力} = y^* - y = 0.164 - 0.10 = 0.064$
第(2)题
计算新压力下的相平衡常数$n'$
$n' = \frac{E}{p'} = \frac{166}{0.5065} \approx 327.7$
计算气相平衡对应的液相浓度$x^*$
$x^* = \frac{y}{n'} = \frac{0.10}{327.7} \approx 3.05 \times 10^{-4}$
比较实际液相浓度$x$与$x^*$
实际液相浓度$x = 0.0001$,因$x^* > x$,说明液相实际浓度低于平衡浓度,CO₂从气相向液相传递(吸收过程)。
推动力计算
$\text{推动力} = x^* - x = 3.05 \times 10^{-4} - 1 \times 10^{-4} = 2.05 \times 10^{-4}$