二、填空(每空一分,共20分)●有效数字是指________,=5.00表示________位有效数字。●有效数字不仅表示________,还反映出测定的________。●pH=4.765为________位有效数字,m= 9.27g的有效数字可看作________位。2●pH=3.24的有效数字为________位,lgK=8.7的有效数字为________位。(12)●25.5508有________位有效数字,若保留3位有效数字,应按________的原则修约为________________2●准确度高低用________衡量,精密度高低用________衡量(15)2●对于常量组分的测定,一般要求分析结果保留________位有效数字,对于微量组分的测定一般要求保留________位有效数字,对于各种误差和偏差的计算一般要求保留________________________位有效数字(13)3●常用分析天平(万分之一)可称准至________。对于一般滴定分析的准确度,要求相对误差≤0.1%,用减量法称取样品时,一般至少应称取________,滴定时所用溶液体积至少要________(12)3●定量分析中,________误差影响测定结果的准确度,________误差影响结果的精密度。(12.14)●滴定剂含有被测组分造成________误差。3●某样品三次平行测定的结果为25.40、25.21、25.32,平均值为________,相对平均偏差为________(12.13.14)●分析化学基准物纯度必须大于________;常量滴定分析必须控制的最小体积应≥________mL。●作为基准物质必须符合、、和。●滴定分析法对滴定反应的要求是、、和。5●0.1011标准溶液对(=126.07)的滴定度为________,若滴定0.1560草酸试样时用去该溶液22.60,则试样中的质量分数为________。(13.14)3●0.1000标准溶液对(M()=106.0)的滴定度为________,若滴定0.1250试样时用去该溶液22.50,则试样中的质量分数为________________(12.15)●酸碱指示剂的理论变色点为。当允许误差为±0.1%,强碱滴定一元弱酸时,目视直接滴定的条件是。●用0.1000标准溶液滴定0.1000时,突跃为9.70~4.30;当用0.0100滴定0.0100时,突跃为________________________________,可选________作指示剂。6●强酸滴定弱碱的滴定曲线,其pH突跃范围的大小主要与________________有关,其次还与________有关。(12.13.14)●当允许误差为±0.1%,强酸滴定一元弱碱时,目视直接滴定的条件是。●和均可用来标定溶液,但二者相比更适合用作基准物,原因是________________●标定溶液浓度,可选或为基准物。若中含有水,标定结果________,若硼砂部分失去结晶水,标定结果________。若两者均处理得当,没有以上问题,则选________(两者之一)作为基准物更好,其原因是________________________________________。●计算一元弱酸溶液pH值的最简式为。●计算一元弱碱溶液pH值的最简式为。●计算弱酸及其盐缓冲溶液pH制的最简式为________________________。●NaH2PO4的质子平衡方程式为________________________________________________________________________________________________________________________。●Na2HPO4的质子平衡方程式为。●(NH4)2HPO4的质子平衡方程式(PBE)为。●HAc+H2CO3混合溶液的质子平衡方程式(PBE)为。4●在水溶液中的质子条件是(12.14)2●在水溶液中的质子条件式为________________________________________(13)●在水溶液中的质子条件式为________________________________________●用0.1000标准溶液滴定0.1000一元弱酸,化学计量点时消耗24.36,当消耗标准溶液12.18使溶液的值为4.21,此一元弱酸的为________。2●0.1的(=1.82,=7.00),用同浓度滴定时,滴定曲线上出现________个突跃。2●用0.1滴定同浓度的酒石酸(=3.04,=4.37),滴定曲线有________个突跃。(12)●用0.1滴定同浓度的邻苯二甲酸(=2.89,=5.54),滴定曲线有________个突跃。●双指示剂法测定混合碱时,若V1﹥V2,且均大于零,则溶液的组成为________。2●有一混合碱液,用滴至酚酞终点,消耗34.12,接着加入甲基橙,再用滴至橙色,又消耗盐酸15.66,则此混合碱的组成为________________2●配位滴定中若要求滴定误差TE≤±0.1%,△pM≈0.3,则单一金属离子能被直接滴定的条件为________________,(13.15)6●配位滴定中,当被测离子M浓度为干扰离子N浓度十分之一(10倍,相等)时,欲用控制酸度法滴定M,要求TE≤±0.5%,△pM≈0.3,需lgcMKMY’________________,则△lgK________________________________________________________。(12.14)●用EDTA滴定金属离子Fe3+时,需控制溶液的最高值应为________,最低值应为________。(可参看附表附图)●在配位滴定中,为了使滴定突跃增大,一般来说,值应较大,但也不能太大,因为同时还要考虑到待测金属离子的________和________的使用范围。●配位滴定法中,金属离子的配位效应计算式为,的酸效应计算式为。4●在配位滴定中溶液的越小,的酸效应系数________,条件稳定常数________。(13.14)●配位滴定法中,金属离子的配位效应是指,EDTA的酸效应是指。3●对于不能形成配合物或者形成的配合物不稳定的情况,需要进行配位滴定时,可采用________方式。(12)2●高锰酸钾是强氧化剂,一般在________条件下使用;碘与硫代硫酸钠的反应应该在________溶液中进行;而沉淀滴定法中的摩尔法只能在________________________溶液中进行。(12)●氧化还原滴定中,用氧化剂滴定还原剂时,如果有关电对都是可逆电对,则滴定百分率为处电位,是还原剂电对的条件电极电位。化学计量点附近(±0.1%)电位突跃范围是________________________________________________________________________________________________________________________________________________●用氧化剂滴定还原剂时,如果有关电对都是可逆电对,则滴定百分率为________处电位,是氧化剂电对的条件电极电位。化学计量点附近(±0.1%)电位突跃范围是________________________________________________________________________________________________________________________________________●酸性条件下,和的反应速度的特点是________,这是因为它是________反应,加快了和地反应,它是________,该反应是________。●在氧化还原滴定法中,表示滴定过程中________随________变化的曲线称滴定曲线,电位突跃范围的大小与两电对的________有关,差值越________,突跃越________(15)●碘量法测铜时,由于沉淀吸附,使结果________,所以在接近终点时,加入的作用是________________________________。3●碘量法中常用和标准溶液,滴定应在________条件下进行,测定中含量时,应先加入过量的溶液,再用标准溶液滴定,指示剂淀粉溶液应在________时加入。(13.14)●法测铁时,指示剂是________,在________和________介质中进行。(15)●间接碘量法的基本反应为________________________和________________________________,和的反应须在________溶液中进行;若用间接碘量法测定电镀液中含量,指示剂应在________时加入;为防止的干扰,应加入,使生成配离子。●中铜含量的测定,用作滴定剂,指示剂是________,为减少对的吸附,可加入试剂。●质量为m g的有机化合物,以浓H2SO4消化,使N转化为NH4HSO4,并沉淀为(NH4)2PtCl6,再灼烧为G g的Pt,则试样中N%的计算式为。3●聚集速率和定向速率的相对大小直接影响沉淀的类型,其中聚集速率主要由________决定,定向速率主要由________决定。2●如果沉淀形成时的聚集速率大于定向速率,则得到________沉淀,反之则得到________沉淀。(13.15)●重量分析中,沉淀的类型主要取决于________和________。●重量分析法中,以Fe2O3称重Fe3O4,化学因子F=________________________________________________________________●重量分析中,Ca2+形成CaC2O4沉淀,经灼烧得CaO产物,因此相当于CaO的KHC2O4·H2C2O4的化学因子是:F=。4●影响沉淀纯度的因素是________和________。(12.14)●重量分析对称量形式的要求是:________________和________●用摩尔法测定pH=8.0的KI溶液中的I-,测定结果将会________。4●佛尔哈德法测定时,必须先加入滴定剂,再加入指示剂________________。(12.13.14)●佛尔哈德法以________为指示剂,酸度条件为________________________________________________●摩尔法测定所选用的指示剂为________,酸度条件是________________________。(15)2●画出单波长单光束分光光度计的组成框图。●光度法显色条件的选择主要有:________,________,________和________。5●在光度法定量分析中,参比溶液的选择非常重要。如果显色剂或其他略有吸收,应用________作参比溶液;如果仅配合物有色,则可用________作参比。(12.13.14)●今有两份具有不同浓度的同一吸收物质溶液A和B,用普通光度法测得其透光率分别为TA=20%,TB=8.0%。现以A为参比,调整其吸光度为0.00,则测得B的吸光度应为________。●分光光度法用于高含量组分测定时,常采用________。2●用普通分光光度法测定铜,测得样品的=5.0%,标液的=10.0%,如采用示差法中高含量法进行测定,则样品的=________,示差法读数标尺放大了________倍。●在多组分体系中,若各种吸光物质之间没有相互作用,这是体系的总吸光度等于________吸光度之和,即吸光度具有________。●吸光光度法中,影响有色配合物摩尔吸收系数的主要因素是。●某有色溶液符合郎伯-比尔定律,其浓度为C,透光率为T。当其浓度为c/2时,透光率为
二、填空(每空一分,共20分)
●有效数字是指________,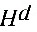 =5.00表示________位有效数字。
=5.00表示________位有效数字。
●有效数字不仅表示________,还反映出测定的________。
●pH=4.765为________位有效数字,m= 9.27g的有效数字可看作________位。
2●pH=3.24的有效数字为________位,lgK=8.7的有效数字为________位。(12)
●25.5508有________位有效数字,若保留3位有效数字,应按________的原则修约为________________
2●准确度高低用________衡量,精密度高低用________衡量(15)
2●对于常量组分的测定,一般要求分析结果保留________位有效数字,对于微量组分的测定一般要求保留________位有效数字,对于各种误差和偏差的计算一般要求保留________________________位有效数字(13)
3●常用分析天平(万分之一)可称准至________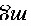 。对于一般滴定分析的准确度,要求相对误差≤0.1%,用减量法称取样品时,一般至少应称取________
。对于一般滴定分析的准确度,要求相对误差≤0.1%,用减量法称取样品时,一般至少应称取________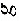 ,滴定时所用溶液体积至少要________
,滴定时所用溶液体积至少要________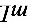 (12)
(12)
3●定量分析中,________误差影响测定结果的准确度,________误差影响结果的精密度。(12.14)
●滴定剂含有被测组分造成________误差。
3●某样品三次平行测定的结果为25.40、25.21、25.32,平均值为________,相对平均偏差为________(12.13.14)
●分析化学基准物纯度必须大于________;常量滴定分析必须控制的最小体积应≥________mL。
●作为基准物质必须符合、、和。
●滴定分析法对滴定反应的要求是、、和。
5●0.1011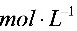
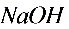 标准溶液对
标准溶液对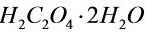 (
(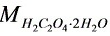 =126.07)的滴定度为________
=126.07)的滴定度为________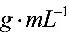 ,若滴定0.1560
,若滴定0.1560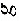 草酸试样时用去该
草酸试样时用去该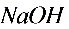 溶液22.60
溶液22.60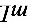 ,则试样中
,则试样中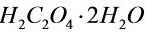 的质量分数为________。(13.14)
的质量分数为________。(13.14)
3●0.1000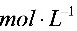
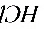 标准溶液对
标准溶液对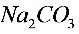 (M(
(M(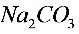 )=106.0)的滴定度为________
)=106.0)的滴定度为________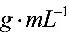 ,若滴定0.1250
,若滴定0.1250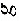
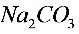 试样时用去该
试样时用去该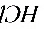 溶液22.50
溶液22.50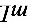 ,则试样中
,则试样中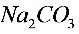 的质量分数为________________(12.15)
的质量分数为________________(12.15)
●酸碱指示剂的理论变色点为。当允许误差为±0.1%,强碱滴定一元弱酸时,目视直接滴定的条件是。
●用0.1000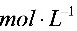
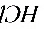 标准溶液滴定0.1000
标准溶液滴定0.1000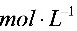
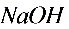 时,
时,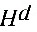 突跃为9.70~4.30;当用0.0100
突跃为9.70~4.30;当用0.0100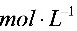
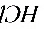 滴定0.0100
滴定0.0100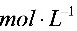
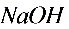 时,
时,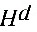 突跃为________________________________,可选________作指示剂。
突跃为________________________________,可选________作指示剂。
6●强酸滴定弱碱的滴定曲线,其pH突跃范围的大小主要与________________有关,其次还与________有关。(12.13.14)
●当允许误差为±0.1%,强酸滴定一元弱碱时,目视直接滴定的条件是。
●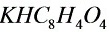 和
和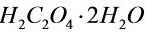 均可用来标定
均可用来标定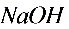 溶液,但二者相比
溶液,但二者相比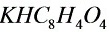 更适合用作基准物,原因是
更适合用作基准物,原因是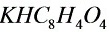 ________________
________________
●标定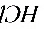 溶液浓度,可选
溶液浓度,可选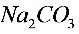 或
或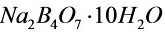 为基准物。若
为基准物。若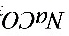 中含有水,标定结果________,若硼砂部分失去结晶水,标定结果________。若两者均处理得当,没有以上问题,则选________(两者之一)作为基准物更好,其原因是
中含有水,标定结果________,若硼砂部分失去结晶水,标定结果________。若两者均处理得当,没有以上问题,则选________(两者之一)作为基准物更好,其原因是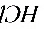 ________________________________________。
________________________________________。
●计算一元弱酸溶液pH值的最简式为。
●计算一元弱碱溶液pH值的最简式为。
●计算弱酸及其盐缓冲溶液pH制的最简式为________________________。
●NaH2PO4的质子平衡方程式为________________________________________________________________________________________________________________________。
●Na2HPO4的质子平衡方程式为。
●(NH4)2HPO4的质子平衡方程式(PBE)为。
●HAc+H2CO3混合溶液的质子平衡方程式(PBE)为。
4●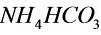 在水溶液中的质子条件是
在水溶液中的质子条件是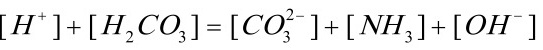 (12.14)
(12.14)
2●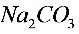 在水溶液中的质子条件式为________
在水溶液中的质子条件式为________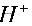 ________
________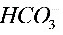 ________
________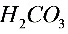 ________
________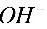 ________(13)
________(13)
●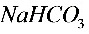 在水溶液中的质子条件式为________
在水溶液中的质子条件式为________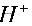 ________
________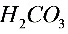 ________
________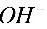 ________
________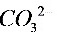 ________
________
●用0.1000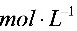
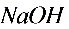 标准溶液滴定0.1000
标准溶液滴定0.1000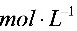 一元弱酸
一元弱酸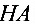 ,化学计量点时消耗
,化学计量点时消耗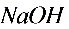 24.36
24.36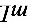 ,当消耗
,当消耗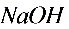 标准溶液12.18
标准溶液12.18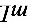 使溶液的
使溶液的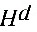 值为4.21,此一元弱酸
值为4.21,此一元弱酸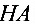 的
的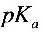 为________。
为________。
2●0.1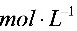 的
的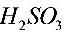 (
(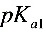 =1.82,
=1.82,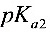 =7.00),用同浓度
=7.00),用同浓度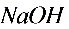 滴定时,滴定曲线上出现________个
滴定时,滴定曲线上出现________个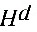 突跃。
突跃。
2●用0.1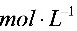
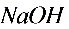 滴定同浓度的酒石酸(
滴定同浓度的酒石酸(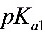 =3.04,
=3.04,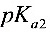 =4.37),滴定曲线有________个
=4.37),滴定曲线有________个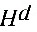 突跃。(12)
突跃。(12)
●用0.1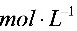
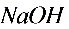 滴定同浓度的邻苯二甲酸(
滴定同浓度的邻苯二甲酸(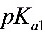 =2.89,
=2.89,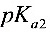 =5.54),滴定曲线有________个
=5.54),滴定曲线有________个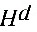 突跃。
突跃。
●双指示剂法测定混合碱时,若V1﹥V2,且均大于零,则溶液的组成为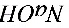 ________
________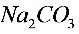 。
。
2●有一混合碱液,用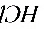 滴至酚酞终点,消耗34.12
滴至酚酞终点,消耗34.12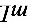 ,接着加入甲基橙,再用
,接着加入甲基橙,再用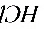 滴至橙色,又消耗盐酸15.66
滴至橙色,又消耗盐酸15.66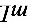 ,则此混合碱的组成为
,则此混合碱的组成为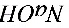 ________
________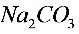 ________
________
2●配位滴定中若要求滴定误差TE≤±0.1%,△pM≈0.3,则单一金属离子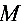 能被
能被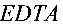 直接滴定的条件为
直接滴定的条件为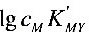 ________________,(13.15)
________________,(13.15)
6●配位滴定中,当被测离子M浓度为干扰离子N浓度十分之一(10倍,相等)时,欲用控制酸度法滴定M,要求TE≤±0.5%,△pM≈0.3,需lgcMKMY’________________,则△lgK________________________________________________________。(12.14)
●用EDTA滴定金属离子Fe3+时,需控制溶液的最高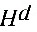 值应为________,最低
值应为________,最低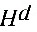 值应为________。(可参看附表附图)
值应为________。(可参看附表附图)
●在 配位滴定中,为了使滴定突跃增大,一般来说,
配位滴定中,为了使滴定突跃增大,一般来说,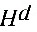 值应较大,但也不能太大,因为同时还要考虑到待测金属离子的________和________的使用范围。
值应较大,但也不能太大,因为同时还要考虑到待测金属离子的________和________的使用范围。
●配位滴定法中,金属离子的配位效应计算式为,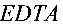 的酸效应计算式为。
的酸效应计算式为。
4●在配位滴定中溶液的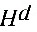 越小,
越小,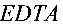 的酸效应系数________,条件稳定常数________。(13.14)
的酸效应系数________,条件稳定常数________。(13.14)
●配位滴定法中,金属离子的配位效应是指,EDTA的酸效应是指。
3●对于不能形成配合物或者形成的配合物不稳定的情况,需要进行配位滴定时,可采用________方式。(12)
2●高锰酸钾是强氧化剂,一般在________条件下使用;碘与硫代硫酸钠的反应应该在________溶液中进行;而沉淀滴定法中的摩尔法只能在________________________溶液中进行。(12)
●氧化还原滴定中,用氧化剂滴定还原剂时,如果有关电对都是可逆电对,则滴定百分率为处电位,是还原剂电对的条件电极电位。化学计量点附近(±0.1%)电位突跃范围是________________________________________________________________________________________________________________________________________________
●用氧化剂滴定还原剂时,如果有关电对都是可逆电对,则滴定百分率为________处电位,是氧化剂电对的条件电极电位。化学计量点附近(±0.1%)电位突跃范围是________________________________________________________________________________________________________________________________________
●酸性条件下,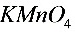 和
和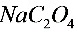 的反应速度的特点是________,这是因为它是________反应,
的反应速度的特点是________,这是因为它是________反应,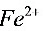 加快了
加快了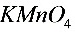 和
和 地反应,它是________,该反应是________。
地反应,它是________,该反应是________。
●在氧化还原滴定法中,表示滴定过程中________随________变化的曲线称滴定曲线,电位突跃范围的大小与两电对的________有关,差值越________,突跃越________(15)
●碘量法测铜时,由于 沉淀吸附
沉淀吸附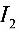 ,使结果________,所以在接近终点时,加入
,使结果________,所以在接近终点时,加入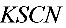 的作用是________
的作用是________ ________
________ ________
________ ________。
________。
3●碘量法中常用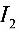 和
和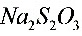 标准溶液,滴定应在________条件下进行,测定
标准溶液,滴定应在________条件下进行,测定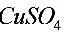 中
中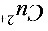 含量时,应先加入过量的
含量时,应先加入过量的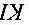 溶液,再用
溶液,再用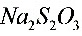 标准溶液滴定,指示剂淀粉溶液应在________时加入。(13.14)
标准溶液滴定,指示剂淀粉溶液应在________时加入。(13.14)
●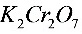 法测铁时,指示剂是________,在________和________介质中进行。(15)
法测铁时,指示剂是________,在________和________介质中进行。(15)
●间接碘量法的基本反应为________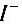 ________
________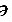 ________
________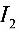 和
和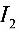 ________
________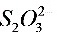 ________________
________________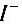 ________
________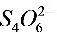 ,
,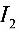 和
和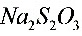 的反应须在________溶液中进行;若用间接碘量法测定电镀液中
的反应须在________溶液中进行;若用间接碘量法测定电镀液中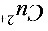 含量,指示剂应在________时加入;为防止
含量,指示剂应在________时加入;为防止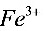 的干扰,应加入
的干扰,应加入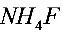 ,使
,使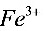 生成
生成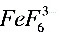 配离子。
配离子。
●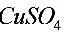 中铜含量的测定,用
中铜含量的测定,用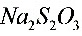 作滴定剂,指示剂是________,为减少
作滴定剂,指示剂是________,为减少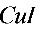 对
对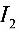 的吸附,可加入试剂
的吸附,可加入试剂 。
。
●质量为m g的有机化合物,以浓H2SO4消化,使N转化为NH4HSO4,并沉淀为(NH4)2PtCl6,再灼烧为G g的Pt,则试样中N%的计算式为。
3●聚集速率和定向速率的相对大小直接影响沉淀的类型,其中聚集速率主要由________决定,定向速率主要由________决定。
2●如果沉淀形成时的聚集速率大于定向速率,则得到________沉淀,反之则得到________沉淀。(13.15)
●重量分析中,沉淀的类型主要取决于________和________。
●重量分析法中,以Fe2O3称重Fe3O4,化学因子F=________________________________________________________________
●重量分析中,Ca2+形成CaC2O4沉淀,经灼烧得CaO产物,因此相当于CaO的KHC2O4·H2C2O4的化学因子是:F=。
4●影响沉淀纯度的因素是________和________。(12.14)
●重量分析对称量形式的要求是:________________和________
●用摩尔法测定pH=8.0的KI溶液中的I-,测定结果将会________。
4●佛尔哈德法测定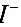 时,必须先加入滴定剂
时,必须先加入滴定剂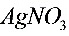 ,再加入指示剂________
,再加入指示剂________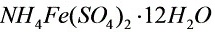 ________。(12.13.14)
________。(12.13.14)
●佛尔哈德法以________为指示剂,酸度条件为________________________________________ ________
________
●摩尔法测定 所选用的指示剂为________,酸度条件是________________________。(15)
所选用的指示剂为________,酸度条件是________________________。(15)
2●画出单波长单光束分光光度计的组成框图。
●光度法显色条件的选择主要有:________,________,________和________。
5●在光度法定量分析中,参比溶液的选择非常重要。如果显色剂或其他略有吸收,应用________作参比溶液;如果仅配合物有色,则可用________作参比。(12.13.14)
●今有两份具有不同浓度的同一吸收物质溶液A和B,用普通光度法测得其透光率分别为TA=20%,TB=8.0%。现以A为参比,调整其吸光度为0.00,则测得B的吸光度应为________。
●分光光度法用于高含量组分测定时,常采用________。
2●用普通分光光度法测定铜,测得样品的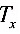 =5.0%,标液的
=5.0%,标液的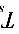 =10.0%,如采用示差法中高含量法进行测定,则样品的
=10.0%,如采用示差法中高含量法进行测定,则样品的 =________,示差法读数标尺放大了________倍。
=________,示差法读数标尺放大了________倍。
●在多组分体系中,若各种吸光物质之间没有相互作用,这是体系的总吸光度等于________吸光度之和,即吸光度具有________。
●吸光光度法中,影响有色配合物摩尔吸收系数的主要因素是。
●某有色溶液符合郎伯-比尔定律,其浓度为C,透光率为T。当其浓度为c/2时,透光率为
题目解答
答案
实际能测量到的数字 2 数量的大小 准确程度 3 4 2 1 6 四去六入五成双 25.6 。 误差 偏差 4 2 1 ~ 2 0.1 0.2 20 系统 偶然 系统 25.31 0.3% 99.9% 20 0.006425 93.08% 0.005300 95.40% 。 8.7 0 ~ 5.30 甲基红(或中性红 K b c 摩尔质量大,可减少称量误差 。 偏高 偏低 硼砂 与两者均按化学计量比 1 ﹕ 2 反应,但硼砂摩尔质量大,称量误差小 pH = pKa + lg[A - ]/[HA] [H + ] + [H 3 PO 4 ] = [OH - ] + [HPO 4 2- ] + 2[PO 4 3- ] [ ]+[ ]+2[ ]=[ ] [ ]+[ ]=[ ]+[ ] 4.21 2 1 1 + + 。 ≥ 6 ≥ 5 ≥ 6 ( 4 )( 5 ) 2.2 1.2 水解 指示剂 越大 越小 间接 强酸性 中性或弱酸性 中性或弱碱性( 6.5-10.5 ) E 2 0 ’ + 3 × 0.059/n 2 — → E 1 0 ’ —3 × 0.059/n 1 200% E 2 0 ’ + 3 × 0.059/n 2 → E 1 0 ’ -3 × 0.059/n 1 先慢后快再慢 自身催化 诱导体 诱导反应 电极电势 滴定百分数 条件电极电势 大 大 偏低 将 转化为 释放出被吸附的 离子 中性或弱酸性 接近终点 二苯胺磺酸钠 硫酸 磷酸 2 -2 → +2 → 2 + 中性或弱酸性 近终点 淀粉 沉淀条件(或相对过饱和度) 沉淀物的本性 无定形 晶形 沉淀的性质(定向速度) 沉淀条件(聚集速度) 2Fe 3 O 4 / 3Fe 2 O 3 共沉淀 后沉淀 组成和化学式符合, 称量形式稳定, 摩尔质量大。 偏低 铁铵矾(或 ) 铁铵矾 强酸性( 0. 1 ~ 1 ) 铬酸钾 中性或弱碱性( 6.5-10.5 ) 显色剂用量 酸度 时间 温度 空白溶液 纯溶剂或蒸馏水 A=0.40 示差法 50% 10 各组分 加和性