题目
某校化学兴趣小组为研究氯气的性质并模拟工业制备漂白粉,设计了下列装置进行实验。已知:①A 中反应为 KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O;②石灰乳的主要成分为 Ca(OH)2,其他杂质不参与反应。答-|||-二-|||-氯-|||-A 答 1 ll m 浓硫酸 石灰乳 NaOH-|||-c D E F(1)写出 B 装置中反应的化学方程式 ____ 。实验结束后,立即将 B 中溶液滴几滴在紫色石蕊试纸上,可观察到的现象是 ____ 。(2)装置 C 的实验目的是验证氯气是否具有漂白性,为此 C 中 I、II、III 处依次放入的物质正确的是 ____ (填编号)。 编号 I II III A 干燥的有色布条 碱石灰 湿润的有色布条 B 干燥的有色布条 浓硫酸 湿润的有色布条 C 湿润的有色布条 浓硫酸 干燥的有色布条 D 湿润的有色布条 碱石灰 干燥的有色布条 (3)待 E 中物质完全反应后,经过一系列加工处理,得到漂白粉样品,其主要成分为 ____ 、 ____ (填化学式)。(4)F 装置的作用是 ____ (用离子方程式表示)(5)为测定(3)中所得漂白粉的有效成分含量。称取 a g 漂白粉样品溶解,往所得溶液中通入 CO2 至不再产生沉淀为止,该过程的化学方程式为 ____ 。若反应生成沉淀的物质的量为 b mol,则该漂白粉中有效成分的质量分数为 ____ (用含 a、b 的式子表示)。
某校化学兴趣小组为研究氯气的性质并模拟工业制备漂白粉,设计了下列装置进行实验。
已知:①A 中反应为 KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O;②石灰乳的主要成分为 Ca(OH)2,其他杂质不参与反应。
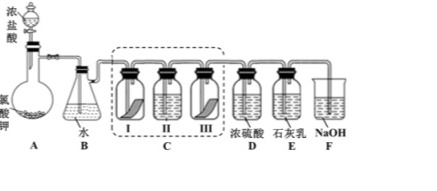
(1)写出 B 装置中反应的化学方程式 ____ 。实验结束后,立即将 B 中溶液滴几滴在紫色石蕊试纸上,可观察到的现象是 ____ 。
(2)装置 C 的实验目的是验证氯气是否具有漂白性,为此 C 中 I、II、III 处依次放入的物质正确的是 ____ (填编号)。
(3)待 E 中物质完全反应后,经过一系列加工处理,得到漂白粉样品,其主要成分为 ____ 、 ____ (填化学式)。
(4)F 装置的作用是 ____ (用离子方程式表示)
(5)为测定(3)中所得漂白粉的有效成分含量。称取 a g 漂白粉样品溶解,往所得溶液中通入 CO2 至不再产生沉淀为止,该过程的化学方程式为 ____ 。若反应生成沉淀的物质的量为 b mol,则该漂白粉中有效成分的质量分数为 ____ (用含 a、b 的式子表示)。
已知:①A 中反应为 KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O;②石灰乳的主要成分为 Ca(OH)2,其他杂质不参与反应。

(1)写出 B 装置中反应的化学方程式 ____ 。实验结束后,立即将 B 中溶液滴几滴在紫色石蕊试纸上,可观察到的现象是 ____ 。
(2)装置 C 的实验目的是验证氯气是否具有漂白性,为此 C 中 I、II、III 处依次放入的物质正确的是 ____ (填编号)。
| 编号 | I | II | III |
| A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| B | 干燥的有色布条 | 浓硫酸 | 湿润的有色布条 |
| C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| D | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
(4)F 装置的作用是 ____ (用离子方程式表示)
(5)为测定(3)中所得漂白粉的有效成分含量。称取 a g 漂白粉样品溶解,往所得溶液中通入 CO2 至不再产生沉淀为止,该过程的化学方程式为 ____ 。若反应生成沉淀的物质的量为 b mol,则该漂白粉中有效成分的质量分数为 ____ (用含 a、b 的式子表示)。
题目解答
答案
解:(1)氯气与水反应生成盐酸和次氯酸,方程式:Cl2+H2O═HCl+HClO;盐酸具有酸性,次氯酸具有漂白性,所以先变红后褪色;
故答案为:Cl2+H2O═HCl+HClO;先变红后褪色;
(2)装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,先通过湿润有色布条,如果有色布条褪色证明次氯酸具有漂白性,然后通过浓硫酸干燥,除去氯气中的水分,再通入干燥的有色布条,有色布条不褪色,说明氯气不具有漂白性,
故答案为:C;
(3)氯气与氢氧化钙反应生成氯化钙、次氯酸钙和水,所以漂白粉成分为氯化钙和次氯酸钙,化学式为:CaCl2,Ca(ClO)2
故答案为:CaCl2,Ca(ClO)2
(4)氯气有毒,不能直接排放到空气中,氯气能与氢氧化钠反应生成氯化钠和次氯酸钠和水,离子方程式:Cl2+2OH-═Cl-+ClO-+H2O
故答案为:Cl2+2OH-═Cl-+ClO-+H2O
(5)次氯酸钙与空气中二氧化碳和水反应生成碳酸钙和次氯酸,方程式:CO2+H2O+Ca(ClO)2 ═CaCO3↓+2HClO,若反应生成沉淀的物质的量为 b mol,依据方程式:CO2+H2O+Ca(ClO)2 ═CaCO3↓+2HClO;
143 1
m b
则m=143b,次氯酸钙的质量分数为$\frac{143b}{a}$×100%;
故答案为:CO2+H2O+Ca(ClO)2 ═CaCO3↓+2HClO;$\frac{143b}{a}$。
故答案为:Cl2+H2O═HCl+HClO;先变红后褪色;
(2)装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,先通过湿润有色布条,如果有色布条褪色证明次氯酸具有漂白性,然后通过浓硫酸干燥,除去氯气中的水分,再通入干燥的有色布条,有色布条不褪色,说明氯气不具有漂白性,
故答案为:C;
(3)氯气与氢氧化钙反应生成氯化钙、次氯酸钙和水,所以漂白粉成分为氯化钙和次氯酸钙,化学式为:CaCl2,Ca(ClO)2
故答案为:CaCl2,Ca(ClO)2
(4)氯气有毒,不能直接排放到空气中,氯气能与氢氧化钠反应生成氯化钠和次氯酸钠和水,离子方程式:Cl2+2OH-═Cl-+ClO-+H2O
故答案为:Cl2+2OH-═Cl-+ClO-+H2O
(5)次氯酸钙与空气中二氧化碳和水反应生成碳酸钙和次氯酸,方程式:CO2+H2O+Ca(ClO)2 ═CaCO3↓+2HClO,若反应生成沉淀的物质的量为 b mol,依据方程式:CO2+H2O+Ca(ClO)2 ═CaCO3↓+2HClO;
143 1
m b
则m=143b,次氯酸钙的质量分数为$\frac{143b}{a}$×100%;
故答案为:CO2+H2O+Ca(ClO)2 ═CaCO3↓+2HClO;$\frac{143b}{a}$。