题目
已知[CO(NH3)]的电子成对能P=22500cm-1,晶体场分裂能△=11000cm根据晶体场理论写出中心离子的d电子在t和e轨道上的分布,说明配合物的类型。计算该配合物的磁矩和晶体场稳定化能CFSE。
已知[CO(NH3)]的电子成对能P=22500cm-1,晶体场分裂能△=11000cm
根据晶体场理论写出中心离子的d电子在t和e轨道上的分布,说明配合物的类型。计
算该配合物的磁矩和晶体场稳定化能CFSE。
题目解答
答案
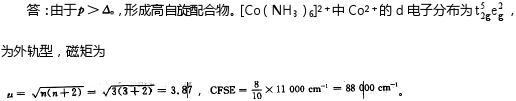
解析
步骤 1:确定配合物类型
根据题目中给出的电子成对能P=22500cm-1和晶体场分裂能△=11000cm-1,由于P>△,说明电子倾向于占据能量较低的轨道,因此形成高自旋配合物。同时,由于△较小,说明配体场较弱,配合物为外轨型配合物。
步骤 2:确定中心离子的d电子分布
${[ Co{(N{H}_{3})}_{6}] }^{2+}$ 中心离子为 ${Co}^{2+}$,其价电子构型为 $3{d}^{7}$。在高自旋配合物中,d电子首先填满能量较低的 ${t}_{2}{g}$ 轨道,然后填满能量较高的 ${e}_{g}$ 轨道。因此,${Co}^{2+}$ 的d电子在 ${t}_{2}{g}$ 和 ${e}_{g}$ 轨道上的分布为 ${t}_{2}{g}^{5}{e}_{g}^{2}$。
步骤 3:计算配合物的磁矩
配合物的磁矩由未配对电子数决定。在 ${t}_{2}{g}^{5}{e}_{g}^{2}$ 的电子分布中,有3个未配对电子。磁矩的计算公式为 $a=\sqrt {n(n+2)}$,其中n为未配对电子数。因此,该配合物的磁矩为 $a=\sqrt {3(3+2)}=3.87$。
步骤 4:计算晶体场稳定化能CFSE
晶体场稳定化能CFSE由d电子在 ${t}_{2}{g}$ 和 ${e}_{g}$ 轨道上的分布决定。在 ${t}_{2}{g}^{5}{e}_{g}^{2}$ 的电子分布中,有5个电子占据 ${t}_{2}{g}$ 轨道,2个电子占据 ${e}_{g}$ 轨道。因此,CFSE的计算公式为 $CFSE=\dfrac {8}{10}\times \Delta $,其中 $\Delta $ 为晶体场分裂能。因此,该配合物的CFSE为 $CFSE=\dfrac {8}{10}\times 11000{cm}^{-1}=8800{cm}^{-1}$。
根据题目中给出的电子成对能P=22500cm-1和晶体场分裂能△=11000cm-1,由于P>△,说明电子倾向于占据能量较低的轨道,因此形成高自旋配合物。同时,由于△较小,说明配体场较弱,配合物为外轨型配合物。
步骤 2:确定中心离子的d电子分布
${[ Co{(N{H}_{3})}_{6}] }^{2+}$ 中心离子为 ${Co}^{2+}$,其价电子构型为 $3{d}^{7}$。在高自旋配合物中,d电子首先填满能量较低的 ${t}_{2}{g}$ 轨道,然后填满能量较高的 ${e}_{g}$ 轨道。因此,${Co}^{2+}$ 的d电子在 ${t}_{2}{g}$ 和 ${e}_{g}$ 轨道上的分布为 ${t}_{2}{g}^{5}{e}_{g}^{2}$。
步骤 3:计算配合物的磁矩
配合物的磁矩由未配对电子数决定。在 ${t}_{2}{g}^{5}{e}_{g}^{2}$ 的电子分布中,有3个未配对电子。磁矩的计算公式为 $a=\sqrt {n(n+2)}$,其中n为未配对电子数。因此,该配合物的磁矩为 $a=\sqrt {3(3+2)}=3.87$。
步骤 4:计算晶体场稳定化能CFSE
晶体场稳定化能CFSE由d电子在 ${t}_{2}{g}$ 和 ${e}_{g}$ 轨道上的分布决定。在 ${t}_{2}{g}^{5}{e}_{g}^{2}$ 的电子分布中,有5个电子占据 ${t}_{2}{g}$ 轨道,2个电子占据 ${e}_{g}$ 轨道。因此,CFSE的计算公式为 $CFSE=\dfrac {8}{10}\times \Delta $,其中 $\Delta $ 为晶体场分裂能。因此,该配合物的CFSE为 $CFSE=\dfrac {8}{10}\times 11000{cm}^{-1}=8800{cm}^{-1}$。