题目
(1)在温度T时将NH4HS(s)置于抽真空的容器中,当反应 (H)_(4)HS(s)leftharpoons -|||-(H)_(3)(g)+(H)_(2)S(g) 达到平衡时,测得总压力为p,则反应的标准平衡常数 ^theta =-|||-() 。

题目解答
答案
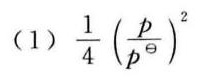
解析
步骤 1:理解反应平衡
反应 $N{H}_{4}HS(s)\rightleftharpoons N{H}_{3}(g)+{H}_{2}S(g)$ 在达到平衡时,固体NH4HS(s)会分解成NH3(g)和H2S(g)。由于NH4HS(s)是固体,其浓度在平衡常数表达式中不考虑,因此平衡常数只与气体的分压有关。
步骤 2:计算分压
由于NH3(g)和H2S(g)的生成量相等,设它们的分压均为x,则总压力p = x + x = 2x。因此,x = p/2。
步骤 3:计算标准平衡常数
标准平衡常数 ${K}^{\theta }$ 与气体分压的乘积有关,即 ${K}^{\theta } = \dfrac{[NH_3][H_2S]}{[NH_4HS]}$。由于NH4HS(s)的浓度在标准平衡常数表达式中不考虑,因此 ${K}^{\theta } = [NH_3][H_2S]$。将分压x代入,得到 ${K}^{\theta } = (\dfrac{p}{2})^2$。由于标准平衡常数是相对于标准压力 ${p}^{\theta }$ 的,因此 ${K}^{\theta } = \dfrac{1}{4}(\dfrac{p}{{p}^{\theta }})^2$。
反应 $N{H}_{4}HS(s)\rightleftharpoons N{H}_{3}(g)+{H}_{2}S(g)$ 在达到平衡时,固体NH4HS(s)会分解成NH3(g)和H2S(g)。由于NH4HS(s)是固体,其浓度在平衡常数表达式中不考虑,因此平衡常数只与气体的分压有关。
步骤 2:计算分压
由于NH3(g)和H2S(g)的生成量相等,设它们的分压均为x,则总压力p = x + x = 2x。因此,x = p/2。
步骤 3:计算标准平衡常数
标准平衡常数 ${K}^{\theta }$ 与气体分压的乘积有关,即 ${K}^{\theta } = \dfrac{[NH_3][H_2S]}{[NH_4HS]}$。由于NH4HS(s)的浓度在标准平衡常数表达式中不考虑,因此 ${K}^{\theta } = [NH_3][H_2S]$。将分压x代入,得到 ${K}^{\theta } = (\dfrac{p}{2})^2$。由于标准平衡常数是相对于标准压力 ${p}^{\theta }$ 的,因此 ${K}^{\theta } = \dfrac{1}{4}(\dfrac{p}{{p}^{\theta }})^2$。