题目
若298 K时,反应的_(p)=8.834,则当p(NO2)=1 kPa, p(N2O4)=10 kPa时,反应将: ( )A. 向生成N2O4方向进行 B. 向生成NO2方向进行 C. 反应恰好达到平衡 D. 不能判断其进行的方向
若298 K时,反应的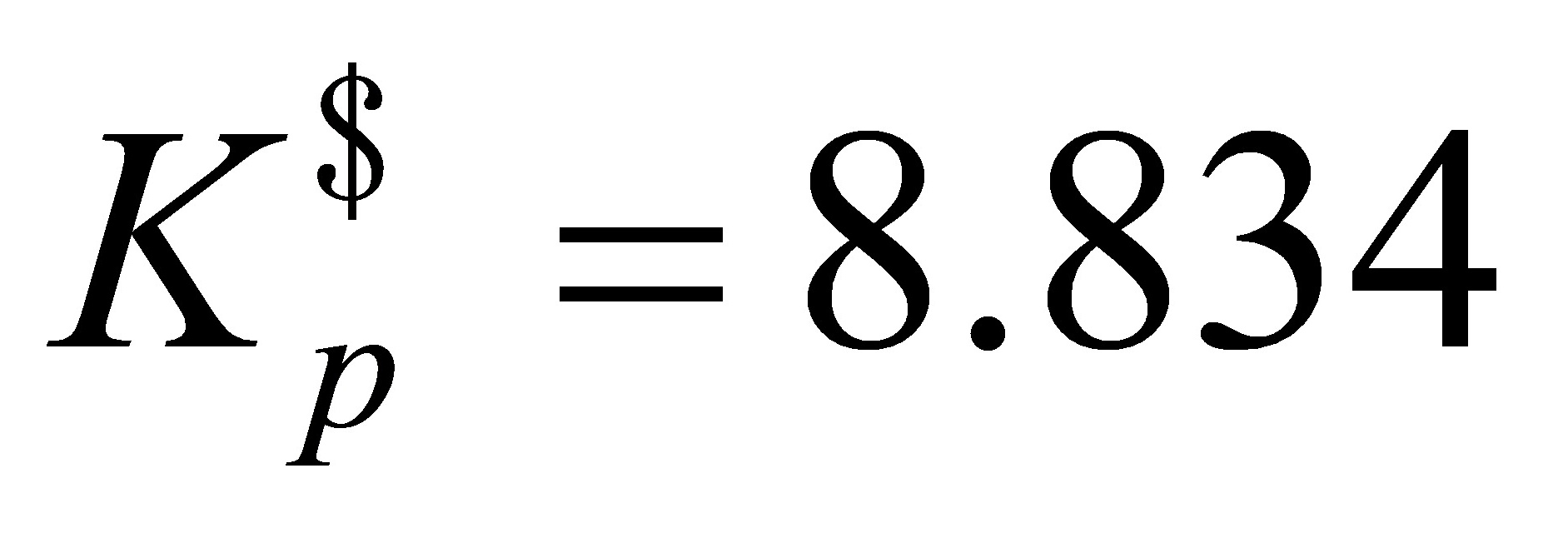 ,则当p(NO2)=1 kPa, p(N2O4)=10 kPa时,反应将: ( )
,则当p(NO2)=1 kPa, p(N2O4)=10 kPa时,反应将: ( )
B. 向生成NO2方向进行
C. 反应恰好达到平衡
D. 不能判断其进行的方向
题目解答
答案
B. 向生成NO2方向进行
解析
本题考查化学反应方向的判断,核心在于利用反应商(Q)与标准平衡常数(K)的关系或吉布斯自由能变化(ΔG)的计算来确定反应进行的方向。关键点如下:
- 反应式:需明确反应为 $2\text{NO}_2 \rightleftharpoons \text{N}_2\text{O}_4$。
- 反应商(Q):根据题目给定压力,计算 $Q = \frac{p(\text{N}_2\text{O}_4)}{p(\text{NO}_2)^2}$。
- 标准平衡常数(K):通过公式 $\Delta G^\circ = -RT \ln K$ 计算,需结合题目中隐含的 $\Delta G^\circ > 0$(导致 $K < 1$)。
- 方向判断:若 $Q > K$,反应逆向进行,生成 $\text{NO}_2$。
步骤1:确定反应式与反应商
反应为 $2\text{NO}_2 \rightleftharpoons \text{N}_2\text{O}_4$,反应商表达式为:
$Q = \frac{p(\text{N}_2\text{O}_4)}{p(\text{NO}_2)^2} = \frac{10}{1^2} = 10.$
步骤2:计算标准平衡常数(K)
由 $\Delta G^\circ = -RT \ln K$,题目隐含 $\Delta G^\circ > 0$,代入数据:
$K = \exp\left(-\frac{\Delta G^\circ}{RT}\right) < 1.$
(例如,若 $\Delta G^\circ = +10000 \, \text{J/mol}$,则 $K \approx 0.0178$。)
步骤3:比较Q与K
此时 $Q = 10 > K$,说明反应物浓度相对产物过高,反应将逆向进行,生成更多 $\text{NO}_2$。