题目
[习题 8-25 ]在25.00mL含 ^2+ 、^2+ 的溶液中加入 .00mL 0.015 00molcdot (L)^-1 EDTA-|||-溶液,用 .01000molcdot (L)^-1(Mg)^2+ 返滴定过量的EDTA,用去17.52mL,然后加入二流丙醇解蔽-|||-^2+ ,释放出EDTA,再用去 .00mL(Mg)^2+ 溶液滴定。计算原试液中 ^2+ 、^2+ 的浓度

题目解答
答案
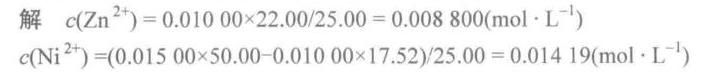
解析
步骤 1:计算EDTA的总摩尔数
EDTA的总摩尔数为 $50.00mL \times 0.01500mol\cdot L^{-1} = 0.7500mmol$。
步骤 2:计算过量EDTA的摩尔数
过量EDTA的摩尔数为 $17.52mL \times 0.01000mol\cdot L^{-1} = 0.1752mmol$。
步骤 3:计算与${Ni}^{2+}$ 和 ${Zn}^{2+}$ 反应的EDTA的摩尔数
与${Ni}^{2+}$ 和 ${Zn}^{2+}$ 反应的EDTA的摩尔数为 $0.7500mmol - 0.1752mmol = 0.5748mmol$。
步骤 4:计算与${Zn}^{2+}$ 反应的EDTA的摩尔数
与${Zn}^{2+}$ 反应的EDTA的摩尔数为 $22.00mL \times 0.01000mol\cdot L^{-1} = 0.2200mmol$。
步骤 5:计算与${Ni}^{2+}$ 反应的EDTA的摩尔数
与${Ni}^{2+}$ 反应的EDTA的摩尔数为 $0.5748mmol - 0.2200mmol = 0.3548mmol$。
步骤 6:计算${Ni}^{2+}$ 和 ${Zn}^{2+}$ 的浓度
${Ni}^{2+}$ 的浓度为 $0.3548mmol / 25.00mL = 0.01419mol\cdot L^{-1}$。
${Zn}^{2+}$ 的浓度为 $0.2200mmol / 25.00mL = 0.008800mol\cdot L^{-1}$。
EDTA的总摩尔数为 $50.00mL \times 0.01500mol\cdot L^{-1} = 0.7500mmol$。
步骤 2:计算过量EDTA的摩尔数
过量EDTA的摩尔数为 $17.52mL \times 0.01000mol\cdot L^{-1} = 0.1752mmol$。
步骤 3:计算与${Ni}^{2+}$ 和 ${Zn}^{2+}$ 反应的EDTA的摩尔数
与${Ni}^{2+}$ 和 ${Zn}^{2+}$ 反应的EDTA的摩尔数为 $0.7500mmol - 0.1752mmol = 0.5748mmol$。
步骤 4:计算与${Zn}^{2+}$ 反应的EDTA的摩尔数
与${Zn}^{2+}$ 反应的EDTA的摩尔数为 $22.00mL \times 0.01000mol\cdot L^{-1} = 0.2200mmol$。
步骤 5:计算与${Ni}^{2+}$ 反应的EDTA的摩尔数
与${Ni}^{2+}$ 反应的EDTA的摩尔数为 $0.5748mmol - 0.2200mmol = 0.3548mmol$。
步骤 6:计算${Ni}^{2+}$ 和 ${Zn}^{2+}$ 的浓度
${Ni}^{2+}$ 的浓度为 $0.3548mmol / 25.00mL = 0.01419mol\cdot L^{-1}$。
${Zn}^{2+}$ 的浓度为 $0.2200mmol / 25.00mL = 0.008800mol\cdot L^{-1}$。