题目
6.已知某一可逆反应 (g)leftharpoons A(g)+B(g) 的 Delta (H)_(m)^theta lt 0 ,则该反应在达到平衡后,以-|||-下哪组条件能使平衡向右移动? ()-|||-A.降温、减压 B.升温、加压 C.升温、减压 D.降温、加压
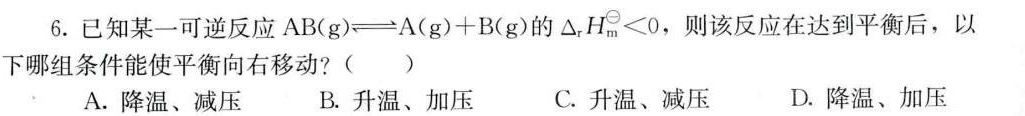
题目解答
答案
解析
步骤 1:理解反应的热效应
反应 $AB(g)\rightleftharpoons A(g)+B(g)$ 的 $\Delta {H}_{m}^{\theta }\lt 0$ 表示这是一个放热反应,即反应物转化为生成物时会释放热量。
步骤 2:应用勒夏特列原理
根据勒夏特列原理,如果改变一个平衡系统的条件,系统会调整自身以抵消这种改变。对于放热反应,降低温度会使平衡向放热方向移动,即向右移动;增加温度会使平衡向吸热方向移动,即向左移动。
步骤 3:分析压力变化对平衡的影响
反应物 $AB(g)$ 是一个分子,而生成物 $A(g)$ 和 $B(g)$ 是两个分子,因此增加压力会使平衡向分子数少的方向移动,即向左移动;减小压力会使平衡向分子数多的方向移动,即向右移动。
步骤 4:综合分析
结合温度和压力对平衡的影响,降温会使平衡向右移动,减压也会使平衡向右移动。因此,降温、减压的条件能使平衡向右移动。
反应 $AB(g)\rightleftharpoons A(g)+B(g)$ 的 $\Delta {H}_{m}^{\theta }\lt 0$ 表示这是一个放热反应,即反应物转化为生成物时会释放热量。
步骤 2:应用勒夏特列原理
根据勒夏特列原理,如果改变一个平衡系统的条件,系统会调整自身以抵消这种改变。对于放热反应,降低温度会使平衡向放热方向移动,即向右移动;增加温度会使平衡向吸热方向移动,即向左移动。
步骤 3:分析压力变化对平衡的影响
反应物 $AB(g)$ 是一个分子,而生成物 $A(g)$ 和 $B(g)$ 是两个分子,因此增加压力会使平衡向分子数少的方向移动,即向左移动;减小压力会使平衡向分子数多的方向移动,即向右移动。
步骤 4:综合分析
结合温度和压力对平衡的影响,降温会使平衡向右移动,减压也会使平衡向右移动。因此,降温、减压的条件能使平衡向右移动。