题目
某电厂采用石灰石湿法进行烟气脱硫,脱硫效率为90%。电厂燃煤含硫为3.6%,含灰为7.7%。试计算:(1)如果按化学剂量比反应,脱除每kgSO2需要多少kg的CaCO3;(2)如果实际应用时CaCO3过量30%,每燃烧一吨煤需要消耗多少CaCO3;(3)脱硫污泥中含有60%的水分和40%CaSO4.2H2O,如果灰渣与脱硫污泥一起排放,每吨燃煤会排放多少污泥?
某电厂采用石灰石湿法进行烟气脱硫,脱硫效率为90%。电厂燃煤含硫为3.6%,含灰为7.7%。试计算:
(1)如果按化学剂量比反应,脱除每kgSO2需要多少kg的CaCO3;
(2)如果实际应用时CaCO3过量30%,每燃烧一吨煤需要消耗多少CaCO3;
(3)脱硫污泥中含有60%的水分和40%CaSO4.2H2O,如果灰渣与脱硫污泥一起排放,每吨燃煤会排放多少污泥?
题目解答
答案
解:
(1)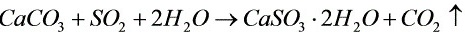
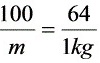 m=1.5625kg
m=1.5625kg
(2)每燃烧1t煤产生SO2约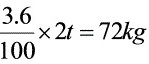 ,约去除72×0.9=64.8kg。
,约去除72×0.9=64.8kg。
因此消耗CaCO3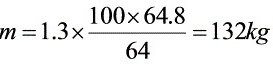 。
。
(3)CaSO4.2H2O生成量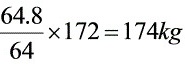 ;
;
则燃烧1t煤脱硫污泥排放量为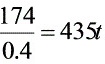 ,同时排放灰渣77kg。
,同时排放灰渣77kg。
解析
步骤 1:计算脱除每kg SO2需要的CaCO3量
根据化学反应方程式$CaCO_{3} + SO_{2} + 2H_{2}O \rightarrow CaSO_{3} \cdot 2H_{2}O + CO_{2}$,每摩尔CaCO3可以脱除一摩尔SO2。CaCO3的摩尔质量为100g/mol,SO2的摩尔质量为64g/mol。因此,脱除每kg SO2需要的CaCO3量为$\dfrac{100}{64}kg$。
步骤 2:计算每燃烧一吨煤需要消耗的CaCO3量
每吨煤含硫量为3.6%,即每吨煤含硫量为36kg。脱硫效率为90%,即每吨煤产生的SO2中90%被脱除,即脱除的SO2量为36kg×90%=32.4kg。根据步骤1的计算,脱除每kg SO2需要的CaCO3量为$\dfrac{100}{64}kg$,因此,每燃烧一吨煤需要消耗的CaCO3量为$\dfrac{100}{64}kg/kg \times 32.4kg \times 1.3$(过量30%)。
步骤 3:计算每吨燃煤会排放的污泥量
脱硫污泥中含有60%的水分和40%的CaSO4.2H2O。根据步骤2的计算,每燃烧一吨煤需要消耗的CaCO3量为132kg,生成的CaSO4.2H2O量为$\dfrac{132kg}{100g/mol} \times 172g/mol = 227.04kg$。因此,每吨燃煤会排放的污泥量为$\dfrac{227.04kg}{0.4} = 567.6kg$,同时排放灰渣77kg。
根据化学反应方程式$CaCO_{3} + SO_{2} + 2H_{2}O \rightarrow CaSO_{3} \cdot 2H_{2}O + CO_{2}$,每摩尔CaCO3可以脱除一摩尔SO2。CaCO3的摩尔质量为100g/mol,SO2的摩尔质量为64g/mol。因此,脱除每kg SO2需要的CaCO3量为$\dfrac{100}{64}kg$。
步骤 2:计算每燃烧一吨煤需要消耗的CaCO3量
每吨煤含硫量为3.6%,即每吨煤含硫量为36kg。脱硫效率为90%,即每吨煤产生的SO2中90%被脱除,即脱除的SO2量为36kg×90%=32.4kg。根据步骤1的计算,脱除每kg SO2需要的CaCO3量为$\dfrac{100}{64}kg$,因此,每燃烧一吨煤需要消耗的CaCO3量为$\dfrac{100}{64}kg/kg \times 32.4kg \times 1.3$(过量30%)。
步骤 3:计算每吨燃煤会排放的污泥量
脱硫污泥中含有60%的水分和40%的CaSO4.2H2O。根据步骤2的计算,每燃烧一吨煤需要消耗的CaCO3量为132kg,生成的CaSO4.2H2O量为$\dfrac{132kg}{100g/mol} \times 172g/mol = 227.04kg$。因此,每吨燃煤会排放的污泥量为$\dfrac{227.04kg}{0.4} = 567.6kg$,同时排放灰渣77kg。