题目
20.根据下列反应 (S)_(2)(O)_(3)^2-+(I)_(2)=(S)_(4)(O)_(6)^2-+2(I)^- 构成的原电池,测得它的电动势 _(MN)=0.444V 已知-|||-电对 _(2)/(I)^- 的E值为 +0.5355V, 则电对 _(4)(O)_(6)^2/(S)_(2)(O)_(3)^2-1 的E值为-|||-A. -0.092v B.0.978V C.0.092V D. -0.978V

题目解答
答案
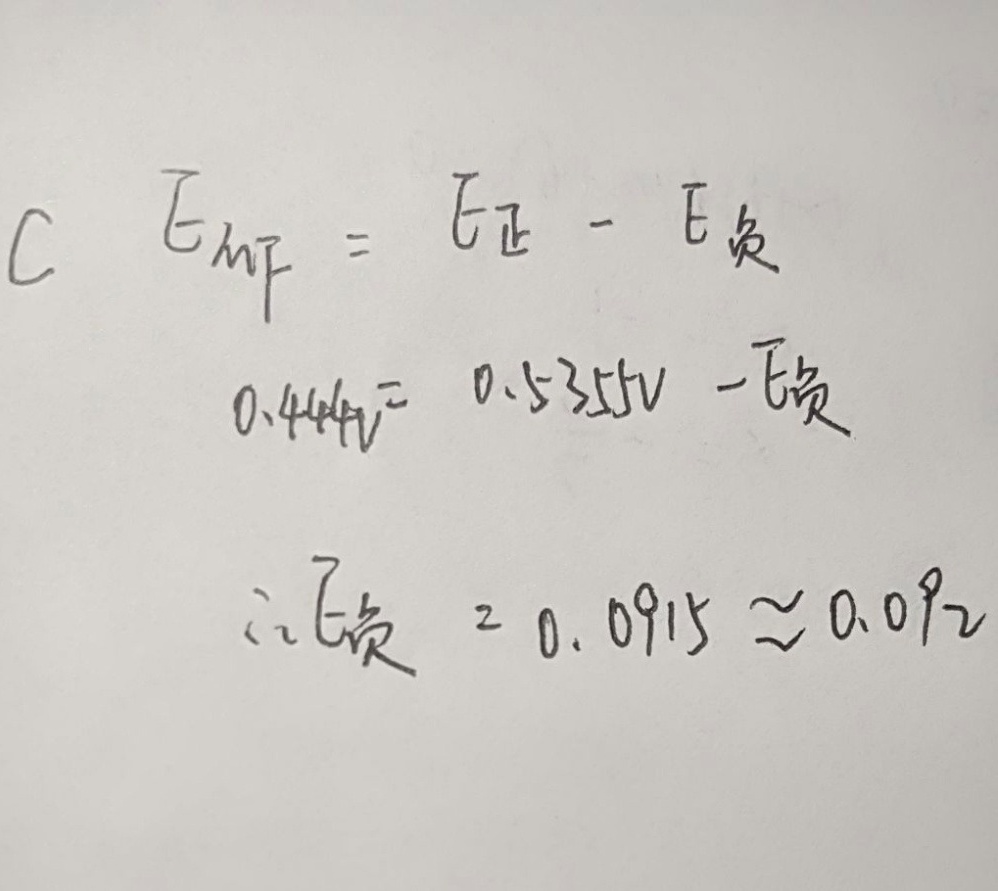
解析
步骤 1:确定原电池的电动势公式
原电池的电动势 ${E}_{MN}$ 可以通过公式 ${E}_{MN} = {E}_{正} - {E}_{负}$ 来计算,其中 ${E}_{正}$ 是正极的电极电势,${E}_{负}$ 是负极的电极电势。
步骤 2:确定正极和负极的电极电势
根据题目,已知电对 ${{I}_{2}/I}$ 的电极电势 ${E}_{正} = +0.5355V$。我们需要求解电对 ${{S}_{4}{O}_{6}}^{2-}/{{S}_{2}{O}_{3}}^{2-}$ 的电极电势 ${E}_{负}$。
步骤 3:计算电对 ${{S}_{4}{O}_{6}}^{2-}/{{S}_{2}{O}_{3}}^{2-}$ 的电极电势
根据原电池的电动势公式,可以得到 ${E}_{MN} = {E}_{正} - {E}_{负}$,代入已知的电动势 ${E}_{MN} = 0.444V$ 和 ${E}_{正} = 0.5355V$,可以求解 ${E}_{负}$。
$0.444V = 0.5355V - {E}_{负}$
${E}_{负} = 0.5355V - 0.444V = 0.0915V \approx 0.092V$
原电池的电动势 ${E}_{MN}$ 可以通过公式 ${E}_{MN} = {E}_{正} - {E}_{负}$ 来计算,其中 ${E}_{正}$ 是正极的电极电势,${E}_{负}$ 是负极的电极电势。
步骤 2:确定正极和负极的电极电势
根据题目,已知电对 ${{I}_{2}/I}$ 的电极电势 ${E}_{正} = +0.5355V$。我们需要求解电对 ${{S}_{4}{O}_{6}}^{2-}/{{S}_{2}{O}_{3}}^{2-}$ 的电极电势 ${E}_{负}$。
步骤 3:计算电对 ${{S}_{4}{O}_{6}}^{2-}/{{S}_{2}{O}_{3}}^{2-}$ 的电极电势
根据原电池的电动势公式,可以得到 ${E}_{MN} = {E}_{正} - {E}_{负}$,代入已知的电动势 ${E}_{MN} = 0.444V$ 和 ${E}_{正} = 0.5355V$,可以求解 ${E}_{负}$。
$0.444V = 0.5355V - {E}_{负}$
${E}_{负} = 0.5355V - 0.444V = 0.0915V \approx 0.092V$