已知298K时E ( MnO4- / Mn2+ ) = 1.51 V, E ( Fe3+ / Fe2+ ) = 0.771 V。 用KMnO4溶液滴定FeSO4溶液,两者在酸性溶液中发生氧化还原反应。 (1) 写出相关反应的离子方程式,计算298K时该反应的标准平衡常数K ; (2) 若开始时 c ( Fe2+ ) = 5.000 × 10-2 mol·L-1, c ( MnO4- ) = 1.000 × 10-2 mol·L-1, V ( Fe2+ ) = 20.00 mL,则反应达到平衡时,需要多少毫升KMnO4 溶液; (3) 平衡时,若c ( H+ ) = 0.2000 mol·L-1, 则 c ( Mn2+ )、c ( Fe3+ )、c ( MnO4- )、c ( Fe2+ )各为多少? (4) 平衡时E( MnO4- / Mn2+ )、E ( Fe3+ / Fe2+ )各为多少?
已知298K时E ( MnO4- / Mn2+ ) = 1.51 V, E
( MnO4- / Mn2+ ) = 1.51 V, E  ( Fe3+ / Fe2+ ) = 0.771 V。 用KMnO4溶液滴定FeSO4溶液,两者在酸性溶液中发生氧化还原反应。 (1) 写出相关反应的离子方程式,计算298K时该反应的标准平衡常数K ; (2) 若开始时 c ( Fe2+ ) = 5.000 × 10-2 mol·L-1, c ( MnO4- ) = 1.000 × 10-2 mol·L-1, V ( Fe2+ ) = 20.00 mL,则反应达到平衡时,需要多少毫升KMnO4 溶液; (3) 平衡时,若c ( H+ ) = 0.2000 mol·L-1, 则 c ( Mn2+ )、c ( Fe3+ )、c ( MnO4- )、c ( Fe2+ )各为多少? (4) 平衡时E( MnO4- / Mn2+ )、E ( Fe3+ / Fe2+ )各为多少?
( Fe3+ / Fe2+ ) = 0.771 V。 用KMnO4溶液滴定FeSO4溶液,两者在酸性溶液中发生氧化还原反应。 (1) 写出相关反应的离子方程式,计算298K时该反应的标准平衡常数K ; (2) 若开始时 c ( Fe2+ ) = 5.000 × 10-2 mol·L-1, c ( MnO4- ) = 1.000 × 10-2 mol·L-1, V ( Fe2+ ) = 20.00 mL,则反应达到平衡时,需要多少毫升KMnO4 溶液; (3) 平衡时,若c ( H+ ) = 0.2000 mol·L-1, 则 c ( Mn2+ )、c ( Fe3+ )、c ( MnO4- )、c ( Fe2+ )各为多少? (4) 平衡时E( MnO4- / Mn2+ )、E ( Fe3+ / Fe2+ )各为多少?
题目解答
答案
解:
(1) MnO4- + 5Fe2+ + 8H+  Mn2+ + 5Fe2+ + 4H2O
Mn2+ + 5Fe2+ + 4H2O
lg K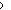 =
= 
K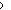 = 2.6 1062
= 2.6 1062
(2) c ( MnO4- ) V ( MnO4- ) = 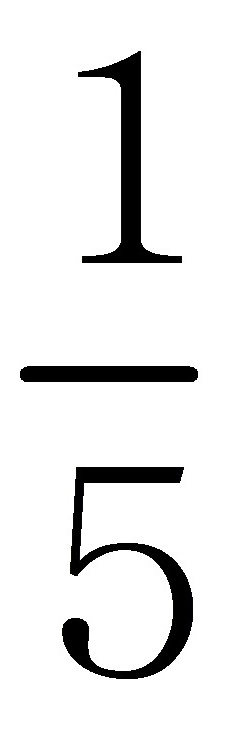 c ( Fe2+ ) V ( Fe2+ )
c ( Fe2+ ) V ( Fe2+ )
V ( MnO4- ) = 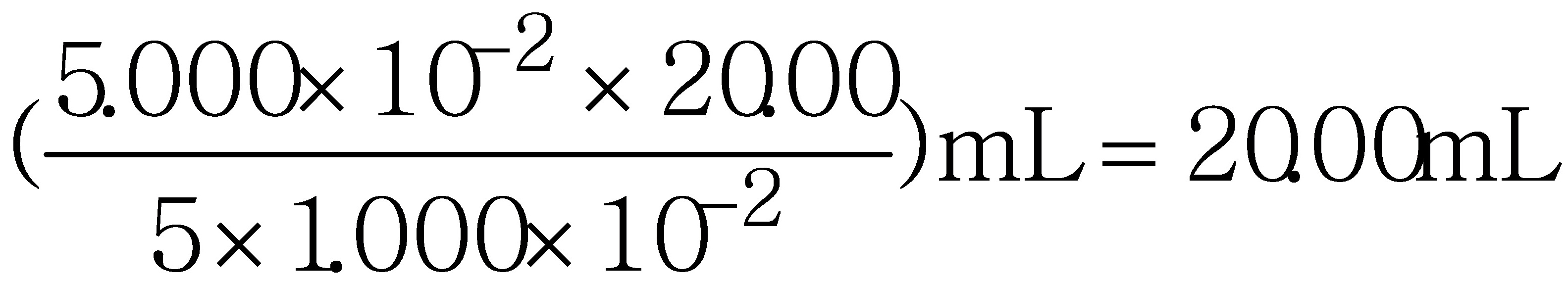
(3) 设 平 衡 时 V(总)= 40.00 mL, c ( MnO4- ) / c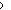 = x, K
= x, K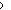 很大。 则
很大。 则
c ( Mn2+ ) / c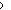 = 5.000 10-3 , c ( Fe2+ ) / c
= 5.000 10-3 , c ( Fe2+ ) / c = x,
= x,
c ( Fe3+ ) / c = 2.500 10-2
= 2.500 10-2
 K
K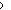
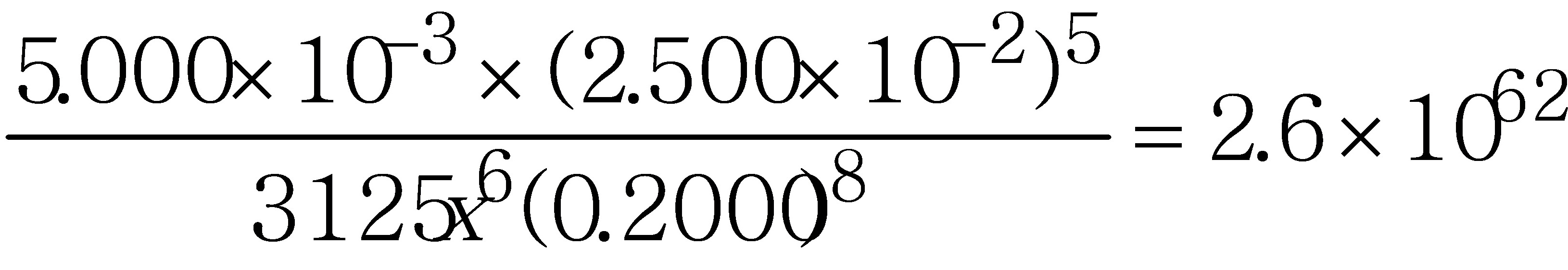
x = 1.7 10-12
10-12
c ( MnO4- ) = 1.7 10-12 mol·L- 1 ; c ( Fe2+ ) = 8.5 10-12 mol·L-1
c ( Fe3+ ) = 2.500 10-2 mol·L-1 ; c ( Mn2+ ) = 5.000 10-3 mol·L-1
(4) 平 衡 时 E ( MnO4- / Mn2+ ) = E ( Fe3+ / Fe2+ )
= 0.771 V + 0.0592 V lg 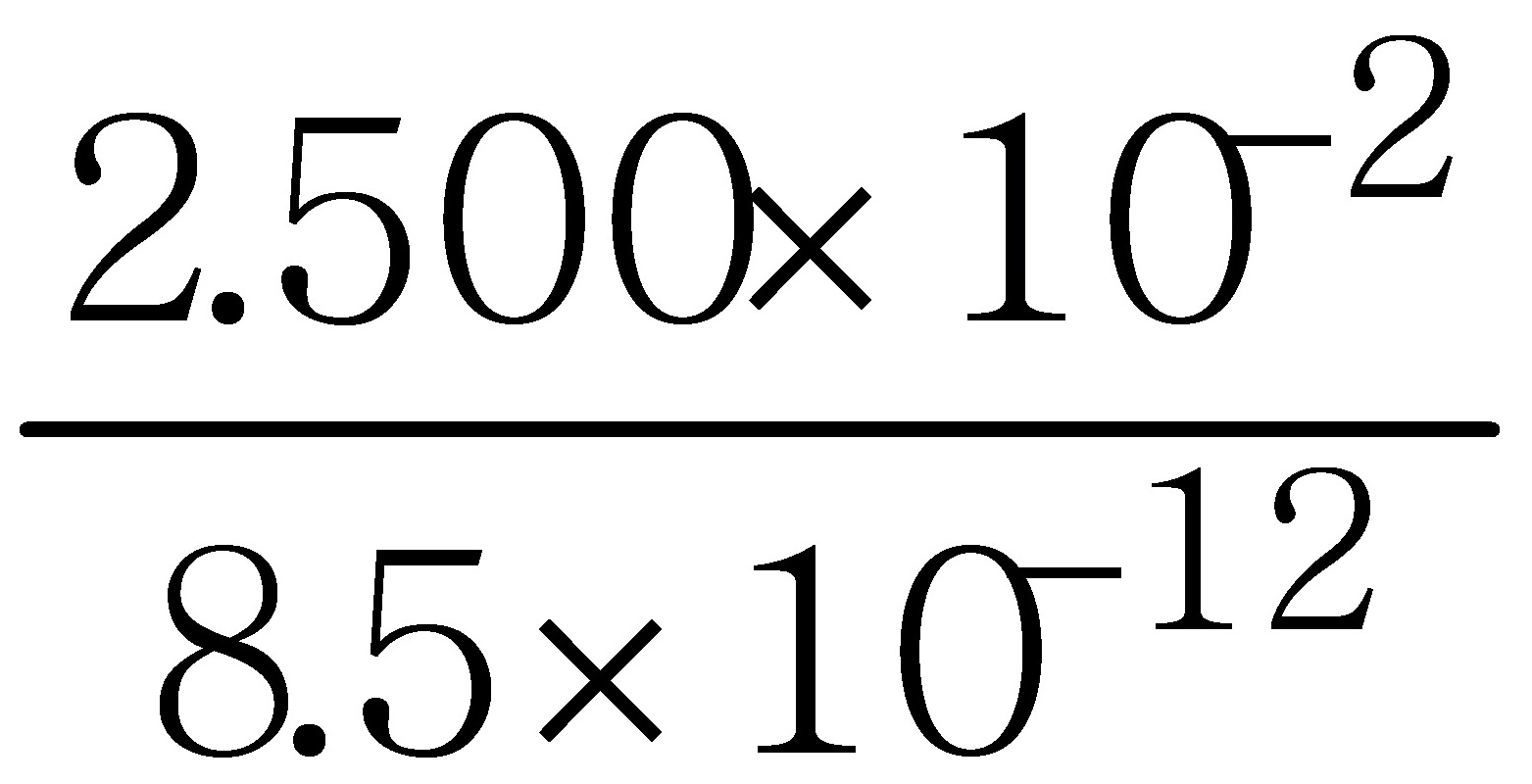
= 1.33 V