298K时,正辛烷C8H18(g)的标准摩尔燃烧焓是–5512.4 kJ·mol–1 ,CO2(g)和液态水的标准生成焓分别为–393.5和–285.8 kJ·mol–1 ;正辛烷,氢气和石墨的标准摩尔熵分别为463.71,130.59和5.69 J·K–1·mol–1。(1)试求算298K时正辛烷生成反应的。(2)增加压力对提高正辛烷的产率是否有利?为什么?(3)升高温度对提高其产率是否有利?为什么?(4)若在298K及标准压力下进行此反应,达到平衡时正辛烷的摩尔分数能否达到0.1?若希望正辛烷的摩尔分数达0.5,试求算298K时需要多大压力才行?
298K时,正辛烷C8H18(g)的标准摩尔燃烧焓是–5512.4 kJ·mol–1 ,CO2(g)和液态水的标准生成焓分别为–393.5和–285.8 kJ·mol–1 ;正辛烷,氢气和石墨的标准摩尔熵分别为463.71,130.59和5.69 J·K–1·mol–1。
(1)试求算298K时正辛烷生成反应的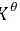 。
。
(2)增加压力对提高正辛烷的产率是否有利?为什么?
(3)升高温度对提高其产率是否有利?为什么?
(4)若在298K及标准压力下进行此反应,达到平衡时正辛烷的摩尔分数能否达到0.1?若希望正辛烷的摩尔分数达0.5,试求算298K时需要多大压力才行?
题目解答
答案
解: 对于正辛烷的生成反应:
8C(s) + 9H2(g) → C8H18(g)
从题中条件可以求此反应的DrHΘm、DrSΘm即可求DrGΘm
(1) DrHΘm =[8´(–393.5) + 9´(–285.8) –5512.4] kJ·mol–1
= –207.8 kJ·mol–1
DrSΘm = [463.71 – 9´(130.59) – 8´5.69] J·K–1·mol–1
= – 757.12 J·K–1·mol–1
DrGΘm = DrHΘm –TDrSΘm =17.8 kJ·mol–1 lnKΘ = – DrGΘm /RT
KΘ= 0.000754
8C(s) + 9H2(g) → C8H18(g)
(2)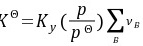 因为
因为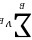 < 0,压力增大,
< 0,压力增大,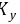 增大
增大
所以增加压力有利于正辛烷的生成
(3)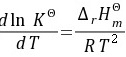 因为
因为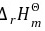 < 0,所以升高温度不利于正辛烷的生成
< 0,所以升高温度不利于正辛烷的生成
(4) 若 yC8H18= 0.1 、yH2 = 0.9 、p = pΘ
Jp = (yC8H18 p/pΘ) /( yH2 p/pΘ )9= 0.258 > 0.000754
所以正辛烷的摩尔分数达不到0.1
若 yC8H18= 0.5 yH2= 0.5
KΘ = (p/pΘ )–8 ´ yC8H18 /( yH2)9 = (p/pΘ )–8/(0.5) 8= 0.000754
p =491.3 kPa
解析
正辛烷生成反应为:8C(s) + 9H2(g) → C8H18(g)
根据题中条件,可以求出此反应的标准摩尔焓变(DrHΘm):
DrHΘm = [8×(–393.5) + 9×(–285.8) –5512.4] kJ·mol–1
= –207.8 kJ·mol–1
步骤 2:计算正辛烷生成反应的标准摩尔熵变(DrSΘm)
根据题中条件,可以求出此反应的标准摩尔熵变(DrSΘm):
DrSΘm = [463.71 – 9×(130.59) – 8×5.69] J·K–1·mol–1
= – 757.12 J·K–1·mol–1
步骤 3:计算正辛烷生成反应的标准摩尔吉布斯自由能变(DrGΘm)
根据标准摩尔焓变和标准摩尔熵变,可以求出此反应的标准摩尔吉布斯自由能变(DrGΘm):
DrGΘm = DrHΘm –TDrSΘm = –207.8 kJ·mol–1 – 298 K × (–757.12 J·K–1·mol–1)
= 17.8 kJ·mol–1
步骤 4:计算正辛烷生成反应的平衡常数(KΘ)
根据标准摩尔吉布斯自由能变,可以求出此反应的平衡常数(KΘ):
lnKΘ = – DrGΘm /RT
KΘ= 0.000754
步骤 5:分析增加压力对正辛烷产率的影响
对于正辛烷的生成反应,∑VE< 0,压力增大,有利于正辛烷的生成。
步骤 6:分析升高温度对正辛烷产率的影响
根据$\dfrac {d\ln {K}^{\theta }}{dT}=\dfrac {{\Delta }_{r}{H}_{m}^{\theta }}{R{T}^{2}}$,因为${H}_{1}{H}_{m}^{\theta }$ m< 0,所以升高温度不利于正辛烷的生成。
步骤 7:计算在298K及标准压力下正辛烷的摩尔分数能否达到0.1
若 yC8H18= 0.1 、yH2 = 0.9 、p = pΘ
Jp = (yC8H18 p/pΘ) /( yH2 p/pΘ )9= 0.258 > 0.000754
所以正辛烷的摩尔分数达不到0.1
步骤 8:计算若希望正辛烷的摩尔分数达0.5,298K时需要多大压力
若 yC8H18= 0.5 yH2= 0.5
KΘ = (p/pΘ )–8 ´ yC8H18 /( yH2)9 = (p/pΘ )–8/(0.5) 8= 0.000754
p =491.3 kPa