题目
1.(河北师范大学2000年)向1.0L 1.0mol/L 处于等电点pH的甘氨酸溶液中加入0.33mol的NaOH,所得-|||-溶液的pH值是多少?( (K)_(1)=2.34, (K)_(2)=9.60-|||-A.2.34 B.9.60 C.1.97-|||-D.9.23 E.8.86

题目解答
答案
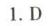
解析
步骤 1:确定甘氨酸在等电点时的浓度和形式
在等电点时,甘氨酸以两性离子形式存在,即 $H_3N^+CH_2COO^-$。由于溶液的初始浓度为1.0 mol/L,因此在等电点时,甘氨酸的浓度为1.0 mol/L。
步骤 2:计算加入NaOH后的反应
加入0.33 mol的NaOH后,NaOH会与甘氨酸的两性离子形式反应,生成甘氨酸的阴离子形式 $H_3N^+CH_2COO^- + OH^- \rightarrow H_2NCH_2COO^- + H_2O$。因此,甘氨酸的阴离子形式的浓度为0.33 mol/L,而两性离子形式的浓度为1.0 mol/L - 0.33 mol/L = 0.67 mol/L。
步骤 3:计算溶液的pH值
根据Henderson-Hasselbalch方程,$pH = pK_a + \log\left(\frac{[A^-]}{[HA]}\right)$,其中$[A^-]$是甘氨酸的阴离子形式的浓度,$[HA]$是甘氨酸的两性离子形式的浓度。由于$pK_a = pK_2 = 9.60$,$[A^-] = 0.33$ mol/L,$[HA] = 0.67$ mol/L,因此$pH = 9.60 + \log\left(\frac{0.33}{0.67}\right) = 9.60 - 0.37 = 9.23$。
在等电点时,甘氨酸以两性离子形式存在,即 $H_3N^+CH_2COO^-$。由于溶液的初始浓度为1.0 mol/L,因此在等电点时,甘氨酸的浓度为1.0 mol/L。
步骤 2:计算加入NaOH后的反应
加入0.33 mol的NaOH后,NaOH会与甘氨酸的两性离子形式反应,生成甘氨酸的阴离子形式 $H_3N^+CH_2COO^- + OH^- \rightarrow H_2NCH_2COO^- + H_2O$。因此,甘氨酸的阴离子形式的浓度为0.33 mol/L,而两性离子形式的浓度为1.0 mol/L - 0.33 mol/L = 0.67 mol/L。
步骤 3:计算溶液的pH值
根据Henderson-Hasselbalch方程,$pH = pK_a + \log\left(\frac{[A^-]}{[HA]}\right)$,其中$[A^-]$是甘氨酸的阴离子形式的浓度,$[HA]$是甘氨酸的两性离子形式的浓度。由于$pK_a = pK_2 = 9.60$,$[A^-] = 0.33$ mol/L,$[HA] = 0.67$ mol/L,因此$pH = 9.60 + \log\left(\frac{0.33}{0.67}\right) = 9.60 - 0.37 = 9.23$。