题目
[5.28]对下列分子和离子CO2, (N{O)_(2)}^+ ,NO2, (N{O)_(2)}^- ,SO2,ClO2,O3等,判断它们的形状,指出-|||-中性分子的极性,以及每个分子和离子的不成对电子数。

题目解答
答案
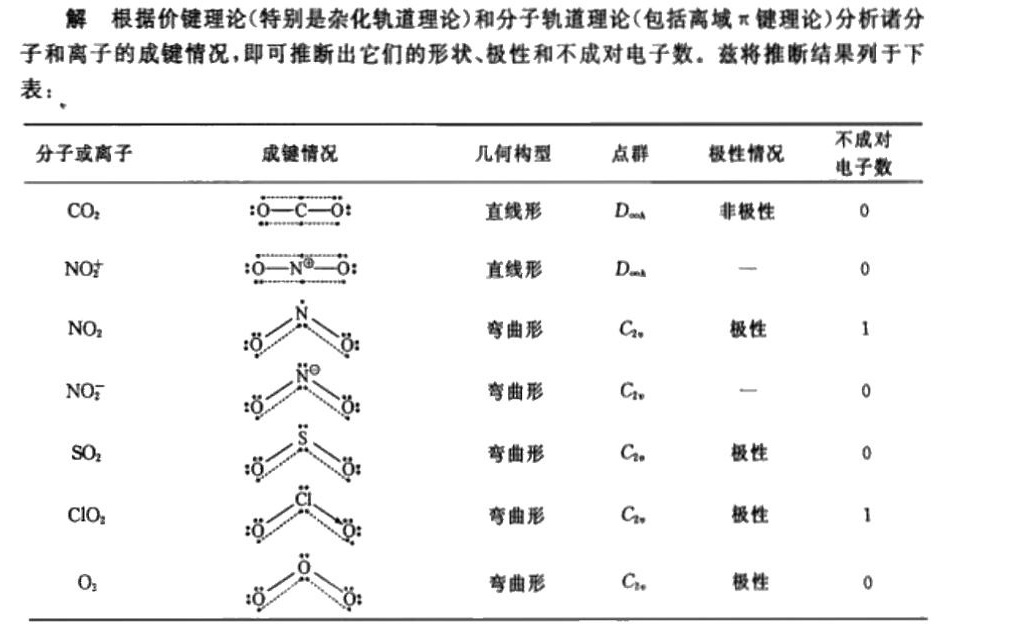
解析
步骤 1:分析CO2的成键情况和几何构型
CO2分子中,碳原子与两个氧原子形成双键,碳原子采取sp杂化,氧原子采取sp2杂化。由于碳原子周围没有孤对电子,分子呈直线形,属于D∞h点群,是非极性分子,没有不成对电子。
步骤 2:分析${N{O}_{2}}^{+}$的成键情况和几何构型
${N{O}_{2}}^{+}$离子中,氮原子与两个氧原子形成双键,氮原子采取sp杂化,氧原子采取sp2杂化。由于氮原子周围没有孤对电子,分子呈直线形,属于D∞h点群,是非极性分子,没有不成对电子。
步骤 3:分析NO2的成键情况和几何构型
NO2分子中,氮原子与两个氧原子形成一个双键和一个单键,氮原子采取sp2杂化,氧原子采取sp2杂化。由于氮原子周围有一个孤对电子,分子呈V形,属于C2v点群,是极性分子,有一个不成对电子。
步骤 4:分析${N{O}_{2}}^{-}$的成键情况和几何构型
${N{O}_{2}}^{-}$离子中,氮原子与两个氧原子形成一个双键和一个单键,氮原子采取sp2杂化,氧原子采取sp2杂化。由于氮原子周围有两个孤对电子,分子呈V形,属于C2v点群,是极性分子,没有不成对电子。
步骤 5:分析SO2的成键情况和几何构型
SO2分子中,硫原子与两个氧原子形成一个双键和一个单键,硫原子采取sp2杂化,氧原子采取sp2杂化。由于硫原子周围有一个孤对电子,分子呈V形,属于C2v点群,是极性分子,没有不成对电子。
步骤 6:分析ClO2的成键情况和几何构型
ClO2分子中,氯原子与两个氧原子形成一个双键和一个单键,氯原子采取sp2杂化,氧原子采取sp2杂化。由于氯原子周围有一个孤对电子,分子呈V形,属于C2v点群,是极性分子,有一个不成对电子。
步骤 7:分析O3的成键情况和几何构型
O3分子中,一个氧原子与另外两个氧原子形成一个双键和一个单键,氧原子采取sp2杂化。由于中心氧原子周围有一个孤对电子,分子呈V形,属于C2v点群,是极性分子,有一个不成对电子。
CO2分子中,碳原子与两个氧原子形成双键,碳原子采取sp杂化,氧原子采取sp2杂化。由于碳原子周围没有孤对电子,分子呈直线形,属于D∞h点群,是非极性分子,没有不成对电子。
步骤 2:分析${N{O}_{2}}^{+}$的成键情况和几何构型
${N{O}_{2}}^{+}$离子中,氮原子与两个氧原子形成双键,氮原子采取sp杂化,氧原子采取sp2杂化。由于氮原子周围没有孤对电子,分子呈直线形,属于D∞h点群,是非极性分子,没有不成对电子。
步骤 3:分析NO2的成键情况和几何构型
NO2分子中,氮原子与两个氧原子形成一个双键和一个单键,氮原子采取sp2杂化,氧原子采取sp2杂化。由于氮原子周围有一个孤对电子,分子呈V形,属于C2v点群,是极性分子,有一个不成对电子。
步骤 4:分析${N{O}_{2}}^{-}$的成键情况和几何构型
${N{O}_{2}}^{-}$离子中,氮原子与两个氧原子形成一个双键和一个单键,氮原子采取sp2杂化,氧原子采取sp2杂化。由于氮原子周围有两个孤对电子,分子呈V形,属于C2v点群,是极性分子,没有不成对电子。
步骤 5:分析SO2的成键情况和几何构型
SO2分子中,硫原子与两个氧原子形成一个双键和一个单键,硫原子采取sp2杂化,氧原子采取sp2杂化。由于硫原子周围有一个孤对电子,分子呈V形,属于C2v点群,是极性分子,没有不成对电子。
步骤 6:分析ClO2的成键情况和几何构型
ClO2分子中,氯原子与两个氧原子形成一个双键和一个单键,氯原子采取sp2杂化,氧原子采取sp2杂化。由于氯原子周围有一个孤对电子,分子呈V形,属于C2v点群,是极性分子,有一个不成对电子。
步骤 7:分析O3的成键情况和几何构型
O3分子中,一个氧原子与另外两个氧原子形成一个双键和一个单键,氧原子采取sp2杂化。由于中心氧原子周围有一个孤对电子,分子呈V形,属于C2v点群,是极性分子,有一个不成对电子。