(mathrm{PCl)}_(5)热分解反应式为(mathrm{PCl)}_(5)(mathrm(g))leftharpoons (mathrm{PCl)}_(3)(mathrm(g))+(mathrm{Cl)}_(2)(mathrm(g))。在10L密闭容器内充入2.0mol (mathrm{PCl)}_(5),700K时有1.3mol (mathrm{PCl)}_(5)分解,求该温度下的(mathrm{K)}^mathrm({Θ)}。若在该密闭容再充入1.0mol (mathrm{Cl)}_(2),(mathrm{PCl)}_(5)分解百分率为多少?
${\mathrm{PCl}}_{5}$热分解反应式为${\mathrm{PCl}}_{5}\left(\mathrm{g}\right)\rightleftharpoons {\mathrm{PCl}}_{3}\left(\mathrm{g}\right)+{\mathrm{Cl}}_{2}\left(\mathrm{g}\right)$。在10L密闭容器内充入2.0mol ${\mathrm{PCl}}_{5}$,700K时有1.3mol ${\mathrm{PCl}}_{5}$分解,求该温度下的${\mathrm{K}}^{\mathrm{\text{Θ}}}$。若在该密闭容再充入1.0mol ${\mathrm{Cl}}_{2}$,${\mathrm{PCl}}_{5}$分解百分率为多少?
题目解答
答案
【答案】
$0.24$;$53.5\mathrm{\%}$。
【解析】
开始时充入$2.0{\mathrm{molPCl}}_{5}$,利用“三段式”进行分析:
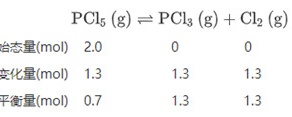
$700\mathrm{K}$时该反应的平衡常数为:${\mathrm{K}}^{\theta }=\dfrac{\dfrac{1.3}{10}\times \dfrac{1.3}{10}}{\dfrac{0.7}{10}}\approx 0.24$;
开始时充入$2.0{\mathrm{molPCl}}_{5}$与$1.0{\mathrm{molCl}}_{2}$,设反应达到平衡时有${\mathrm{amolPCl}}_{5}$发生了分解,利用“三段式”进行分析:

温度不变,平衡常数不变,根据平衡常数列出方程:$\dfrac{\dfrac{\mathrm{a}}{10}\times \dfrac{1.0+\mathrm{a}}{10}}{\dfrac{2.0-\mathrm{a}}{10}}=0.24$
解得:$\mathrm{a}\approx 1.07$,${\mathrm{PCl}}_{5}$的分解百分率为:$\dfrac{1.07\mathrm{mol}}{2.0\mathrm{mol}}\times 100\mathrm{\%}=53.5\mathrm{\%}$。
解析
根据题目,开始时充入$2.0{\mathrm{molPCl}}_{5}$,700K时有$1.3{\mathrm{molPCl}}_{5}$分解。利用“三段式”进行分析:
$P{Cl}_{5}(g)\rightleftharpoons P{Cl}_{3}(g)+{Cl}_{2}(g)$
始态量(mol) 2.0 0 0
变化量(mol) 1.3 1.3 1.3
平衡量(mol) 0.7 1.3 1.3
700K时该反应的平衡常数为:${\mathrm{K}}^{\theta }=\dfrac{\dfrac{1.3}{10}\times \dfrac{1.3}{10}}{\dfrac{0.7}{10}}\approx 0.24$。
步骤 2:计算再充入1.0mol ${\mathrm{Cl}}_{2}$后的${\mathrm{PCl}}_{5}$分解百分率
开始时充入$2.0{\mathrm{molPCl}}_{5}$与$1.0{\mathrm{molCl}}_{2}$,设反应达到平衡时有${\mathrm{amolPCl}}_{5}$发生了分解,利用“三段式”进行分析:
$P{Cl}_{5}(g)\rightleftharpoons P{Cl}_{3}(g)+{Cl}_{2}(g)$
始态量(mol) 2.0 0 1.0
变化量(mol) a a a
平衡量(mol) 2.0-a a 1.0+a
温度不变,平衡常数不变,根据平衡常数列出方程:$\dfrac{\dfrac{\mathrm{a}}{10}\times \dfrac{1.0+\mathrm{a}}{10}}{\dfrac{2.0-\mathrm{a}}{10}}=0.24$
解得:$\mathrm{a}\approx 1.07$,${\mathrm{PCl}}_{5}$的分解百分率为:$\dfrac{1.07\mathrm{mol}}{2.0\mathrm{mol}}\times 100\mathrm{\%}=53.5\mathrm{\%}$。