15.1mol水在其沸点100℃下汽化,求该过程的W,Q, Delta U ,Delta H ,△S 和 △G 。已知水的汽化热为-|||-.26kJcdot (g)^-1 。

题目解答
答案
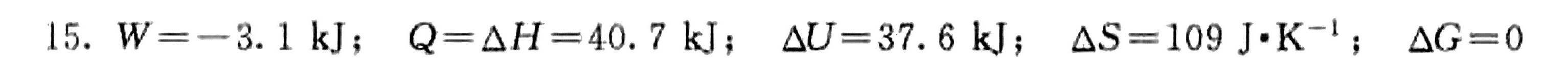
解析
考查要点:本题主要考查相变过程中的热力学函数计算,涉及功(W)、热量(Q)、内能变化(ΔU)、焓变(ΔH)、熵变(ΔS)和吉布斯自由能变(ΔG)的求解。
解题核心思路:
- 功(W):液体汽化时体积膨胀对外做功,公式为 $W = -P\Delta V$,可简化为 $W = -nRT$(忽略液体体积)。
- 热量(Q):恒压过程,$Q = \Delta H$,通过汽化热计算。
- 内能变化(ΔU):利用热力学第一定律 $\Delta U = Q + W$。
- 熵变(ΔS):$\Delta S = \frac{Q}{T}$,注意单位换算。
- 吉布斯自由能变(ΔG):相变平衡时 $\Delta G = 0$。
破题关键:
- 汽化热的单位转换:将汽化热从 $kJ/g$ 转换为 $kJ/mol$。
- 体积变化的简化处理:液体体积远小于气体体积,可忽略液体体积。
1. 计算功(W)
液体汽化时体积膨胀,对外做功为:
$W = -P\Delta V \approx -nRT$
其中 $n=1 \, \text{mol}$,$R=8.314 \, \text{J/mol·K}$,$T=373 \, \text{K}$,代入得:
$W = -(1)(8.314)(373) \, \text{J} \approx -3120 \, \text{J} = -3.1 \, \text{kJ}$
2. 计算热量(Q)和焓变(ΔH)
恒压下 $Q = \Delta H$,汽化热为 $2.26 \, \text{kJ/g}$,水的摩尔质量为 $18 \, \text{g/mol}$,故:
$\Delta H = Q = 2.26 \, \text{kJ/g} \times 18 \, \text{g/mol} = 40.7 \, \text{kJ}$
3. 计算内能变化(ΔU)
根据热力学第一定律:
$\Delta U = Q + W = 40.7 \, \text{kJ} + (-3.1 \, \text{kJ}) = 37.6 \, \text{kJ}$
4. 计算熵变(ΔS)
熵变为:
$\Delta S = \frac{Q}{T} = \frac{40700 \, \text{J}}{373 \, \text{K}} \approx 109 \, \text{J/K}$
5. 计算吉布斯自由能变(ΔG)
在沸点汽化为可逆相变,平衡条件下:
$\Delta G = 0$