题目
反应 A → B 的半衰期t1/2与反应物A的初始浓度无关,在27℃ 时t1/2 = 300 s, 在37℃ 时t1/2 = 100 s。(1) 试问此反应为几级反应?并写出其速率反程;(2) 试求此反应的表观活化能Ea。
反应 A → B 的半衰期t1/2与反应物A的初始浓度无关,在27℃ 时t1/2 = 300 s, 在37℃ 时t1/2 = 100 s。(1) 试问此反应为几级反应?并写出其速率反程;(2) 试求此反应的表观活化能Ea。
题目解答
答案
解: (1) t1/2与浓度无关,是一级反应。 速率方程 r = 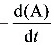 = kA (A)
= kA (A)
(2) 因为k =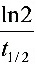
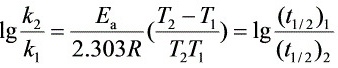
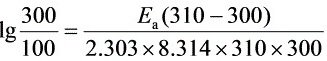
Ea= 85 kJ·mol-1
解析
步骤 1:确定反应级数
半衰期与反应物A的初始浓度无关,说明反应的半衰期与反应物浓度无关,这符合一级反应的特征。因此,此反应为一级反应。
步骤 2:写出速率方程
对于一级反应,其速率方程为:$r = -\dfrac {d[A]}{dt} = k[A]$,其中,$k$为反应速率常数,$[A]$为反应物A的浓度。
步骤 3:计算表观活化能
根据阿伦尼乌斯方程,$\ln k = -\dfrac {E_a}{RT} + \ln A$,其中,$E_a$为表观活化能,$R$为气体常数,$T$为绝对温度,$A$为指前因子。由于半衰期$t_{1/2} = \dfrac {\ln 2}{k}$,可以得到$\ln k = \ln \dfrac {\ln 2}{t_{1/2}}$。将两个温度下的半衰期代入,可以得到两个方程,联立求解得到$E_a$。
半衰期与反应物A的初始浓度无关,说明反应的半衰期与反应物浓度无关,这符合一级反应的特征。因此,此反应为一级反应。
步骤 2:写出速率方程
对于一级反应,其速率方程为:$r = -\dfrac {d[A]}{dt} = k[A]$,其中,$k$为反应速率常数,$[A]$为反应物A的浓度。
步骤 3:计算表观活化能
根据阿伦尼乌斯方程,$\ln k = -\dfrac {E_a}{RT} + \ln A$,其中,$E_a$为表观活化能,$R$为气体常数,$T$为绝对温度,$A$为指前因子。由于半衰期$t_{1/2} = \dfrac {\ln 2}{k}$,可以得到$\ln k = \ln \dfrac {\ln 2}{t_{1/2}}$。将两个温度下的半衰期代入,可以得到两个方程,联立求解得到$E_a$。