题目
化学反应按照不同的分类方法,可以分为化合反应、分解反应、置换反应、复分解反应,也可分为氧化还原反应和非氧化还原反应、离子反应和非离子反应。有下列反应: ①CO 2+C 2CO ②Cu 2(OH) 2CO 3 2CuO+H 2O+CO 2↑ ③2NaOH+Cl 2=NaCl+NaClO+H 2O ④2CO+O 2 2CO 2 ⑤3Fe+4H 2O(g) Fe 3O 4+4H 2 ⑥CuO+H 2 Cu+H 2O ⑦2H 2O 2H 2↑+O 2↑ ⑧CO 2+H 2O=H 2CO 3 (1)其中属于化合反应的有_____________(填序号,下同),属于置换反应的有_____________。 (2)在化学反应前后元素的化合价没有变化的是_______________________。 (3)上述反应中,既是分解反应,又是氧化还原反应的是_____________________。 (4)上述反应中,既是溶液中的离子反应,又是氧化还原反应的是__________。 (5)根据你的理解,氧化还原反应的实质是(___________) A.分子中的原子重新组合 B.氧元素的得失 C.电子的得失或共用电子对的偏移 D.化合价的改变
化学反应按照不同的分类方法,可以分为化合反应、分解反应、置换反应、复分解反应,也可分为氧化还原反应和非氧化还原反应、离子反应和非离子反应。有下列反应:
①CO 2+C 2CO ②Cu
2(OH)
2CO
3
2CO ②Cu
2(OH)
2CO
3
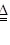 2CuO+H
2O+CO
2↑
2CuO+H
2O+CO
2↑
③2NaOH+Cl 2=NaCl+NaClO+H 2O ④2CO+O 2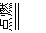 2CO
2
2CO
2
⑤3Fe+4H 2O(g) Fe
3O
4+4H
2 ⑥CuO+H
2
Fe
3O
4+4H
2 ⑥CuO+H
2
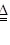 Cu+H
2O
Cu+H
2O
⑦2H 2O 2H
2↑+O
2↑ ⑧CO
2+H
2O=H
2CO
3
2H
2↑+O
2↑ ⑧CO
2+H
2O=H
2CO
3
(1)其中属于化合反应的有_____________(填序号,下同),属于置换反应的有_____________。
(2)在化学反应前后元素的化合价没有变化的是_______________________。
(3)上述反应中,既是分解反应,又是氧化还原反应的是_____________________。
(4)上述反应中,既是溶液中的离子反应,又是氧化还原反应的是__________。
(5)根据你的理解,氧化还原反应的实质是(___________)
①CO 2+C
 2CO ②Cu
2(OH)
2CO
3
2CO ②Cu
2(OH)
2CO
3
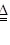 2CuO+H
2O+CO
2↑
2CuO+H
2O+CO
2↑
③2NaOH+Cl 2=NaCl+NaClO+H 2O ④2CO+O 2
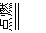 2CO
2
2CO
2
⑤3Fe+4H 2O(g)
 Fe
3O
4+4H
2 ⑥CuO+H
2
Fe
3O
4+4H
2 ⑥CuO+H
2
 Cu+H
2O
Cu+H
2O
⑦2H 2O
 2H
2↑+O
2↑ ⑧CO
2+H
2O=H
2CO
3
2H
2↑+O
2↑ ⑧CO
2+H
2O=H
2CO
3
(1)其中属于化合反应的有_____________(填序号,下同),属于置换反应的有_____________。
(2)在化学反应前后元素的化合价没有变化的是_______________________。
(3)上述反应中,既是分解反应,又是氧化还原反应的是_____________________。
(4)上述反应中,既是溶液中的离子反应,又是氧化还原反应的是__________。
(5)根据你的理解,氧化还原反应的实质是(___________)
A.分子中的原子重新组合
B.氧元素的得失
C.电子的得失或共用电子对的偏移
D.化合价的改变
题目解答
答案
解析
步骤 1:确定反应类型
- 化合反应:两种或两种以上物质生成一种物质的反应。
- 置换反应:一种单质和一种化合物反应生成另一种单质和另一种化合物的反应。
- 分解反应:一种物质分解成两种或两种以上物质的反应。
- 氧化还原反应:反应中存在电子的得失或共用电子对的偏移。
- 离子反应:在溶液中进行的反应,反应物和生成物中至少有一种是离子。
步骤 2:分析每个反应
- ① CO _2+C 高温2CO:化合反应,氧化还原反应。
- ② Cu _2(OH) _2CO _3 些2CuO+H _2O+CO _2↑:分解反应,非氧化还原反应。
- ③ 2NaOH+Cl _2=NaCl+NaClO+H _2O:氧化还原反应,离子反应。
- ④ 2CO+O _2 点燃2CO _2:化合反应,氧化还原反应。
- ⑤ 3Fe+4H _2O(g) 高温Fe _3O _4+4H _2:置换反应,氧化还原反应。
- ⑥ CuO+H _2 些Cu+H _2O:置换反应,氧化还原反应。
- ⑦ 2H _2O 圈2H _2↑+O _2↑:分解反应,氧化还原反应。
- ⑧ CO _2+H _2O=H _2CO _3:化合反应,非氧化还原反应。
步骤 3:回答问题
- (1) 化合反应:①④⑧;置换反应:⑤⑥。
- (2) 化合价没有变化:②⑧。
- (3) 分解反应且氧化还原反应:⑦。
- (4) 离子反应且氧化还原反应:③。
- (5) 氧化还原反应的实质:C.电子的得失或共用电子对的偏移。
- 化合反应:两种或两种以上物质生成一种物质的反应。
- 置换反应:一种单质和一种化合物反应生成另一种单质和另一种化合物的反应。
- 分解反应:一种物质分解成两种或两种以上物质的反应。
- 氧化还原反应:反应中存在电子的得失或共用电子对的偏移。
- 离子反应:在溶液中进行的反应,反应物和生成物中至少有一种是离子。
步骤 2:分析每个反应
- ① CO _2+C 高温2CO:化合反应,氧化还原反应。
- ② Cu _2(OH) _2CO _3 些2CuO+H _2O+CO _2↑:分解反应,非氧化还原反应。
- ③ 2NaOH+Cl _2=NaCl+NaClO+H _2O:氧化还原反应,离子反应。
- ④ 2CO+O _2 点燃2CO _2:化合反应,氧化还原反应。
- ⑤ 3Fe+4H _2O(g) 高温Fe _3O _4+4H _2:置换反应,氧化还原反应。
- ⑥ CuO+H _2 些Cu+H _2O:置换反应,氧化还原反应。
- ⑦ 2H _2O 圈2H _2↑+O _2↑:分解反应,氧化还原反应。
- ⑧ CO _2+H _2O=H _2CO _3:化合反应,非氧化还原反应。
步骤 3:回答问题
- (1) 化合反应:①④⑧;置换反应:⑤⑥。
- (2) 化合价没有变化:②⑧。
- (3) 分解反应且氧化还原反应:⑦。
- (4) 离子反应且氧化还原反应:③。
- (5) 氧化还原反应的实质:C.电子的得失或共用电子对的偏移。