题目
7.3 将NH3·H2O溶液稀释1倍,溶液pH:-|||-A.变为原溶液的 1/2 ; B.降低lg2; C.升高lg2; D.降低 dfrac (1)(2)lg 2 。

题目解答
答案
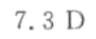
解析
步骤 1:理解NH3·H2O溶液的性质
NH3·H2O(氨水)是一种弱碱,它在水中部分离解为NH4+和OH-离子。溶液的pH值主要由OH-离子的浓度决定。
步骤 2:稀释对pH的影响
当NH3·H2O溶液被稀释时,OH-离子的浓度降低,导致pH值下降。但是,由于NH3·H2O是弱碱,它会部分离解以补充OH-离子的损失,因此pH值的下降幅度小于直接稀释强碱溶液时的幅度。
步骤 3:计算pH值的变化
假设原溶液的pH值为x,稀释后溶液的pH值为y。由于稀释1倍,OH-离子的浓度降低到原来的一半,因此pH值的变化量为$\dfrac {1}{2}\lg 2$。因此,稀释后的pH值为x - $\dfrac {1}{2}\lg 2$。
NH3·H2O(氨水)是一种弱碱,它在水中部分离解为NH4+和OH-离子。溶液的pH值主要由OH-离子的浓度决定。
步骤 2:稀释对pH的影响
当NH3·H2O溶液被稀释时,OH-离子的浓度降低,导致pH值下降。但是,由于NH3·H2O是弱碱,它会部分离解以补充OH-离子的损失,因此pH值的下降幅度小于直接稀释强碱溶液时的幅度。
步骤 3:计算pH值的变化
假设原溶液的pH值为x,稀释后溶液的pH值为y。由于稀释1倍,OH-离子的浓度降低到原来的一半,因此pH值的变化量为$\dfrac {1}{2}\lg 2$。因此,稀释后的pH值为x - $\dfrac {1}{2}\lg 2$。