题目
298 K时,有下列电池:Pt,Cl2(p)|HCl(0.1 mol·kg-1)|AgCl(s)|Ag(s), 试求:(1) 电池的电动势;(2) 电动势温度系数和有1mol电子电量可逆输出时的热效应;(3) AgCl(s)的分解压。已知fHm(AgCl)= -×105 J·mol-1,Ag(s),AgCl(s)和Cl2(g)的规定熵值Sm分别为:,和243.87 J·K-1·mol-1。
298 K时,有下列电池:
Pt,Cl2(p)|HCl(0.1 mol·kg-1)|AgCl(s)|Ag(s), 试求:
(1) 电池的电动势;
(2) 电动势温度系数和有1mol电子电量可逆输出时的热效应;
(3) AgCl(s)的分解压。
已知fHm(AgCl)= -×105 J·mol-1,Ag(s),AgCl(s)和Cl2(g)的规定熵值Sm分别为:
,和243.87 J·K-1·mol-1。
题目解答
答案
电池反应为:
AgCl(s)→Ag(s)+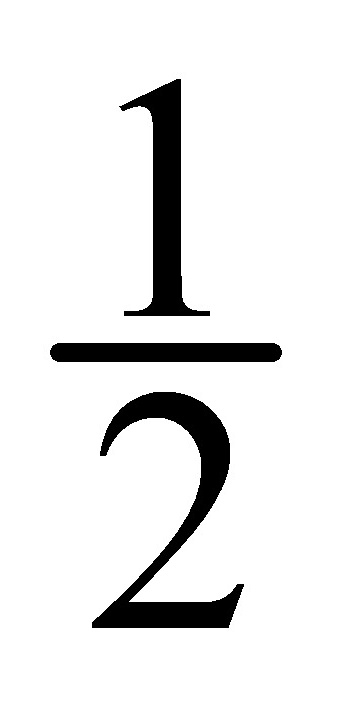 Cl2(p)
Cl2(p)
⑴ 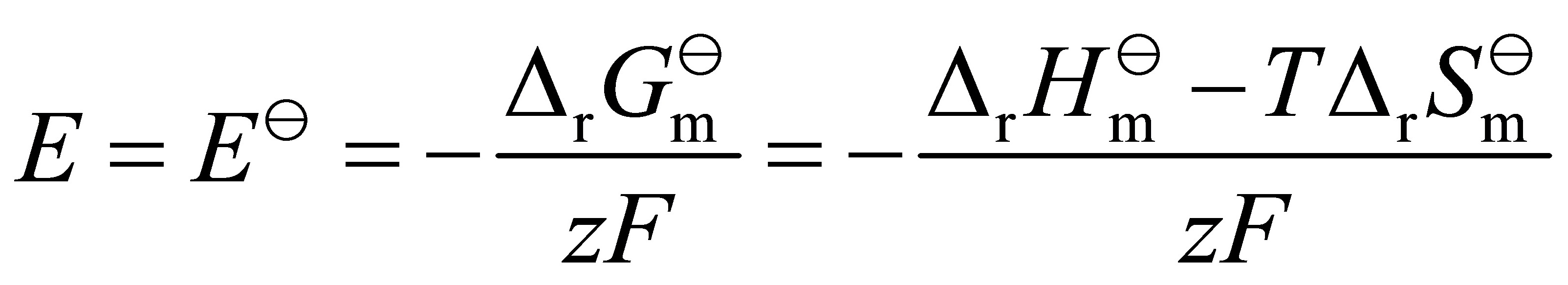
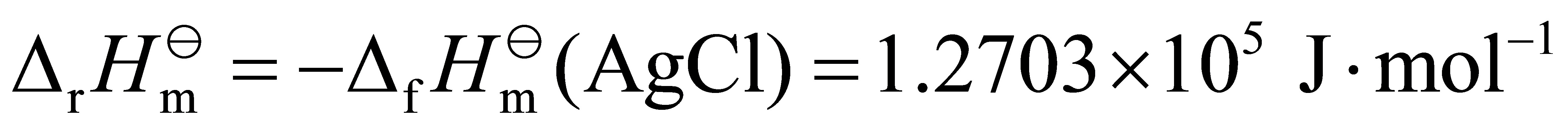
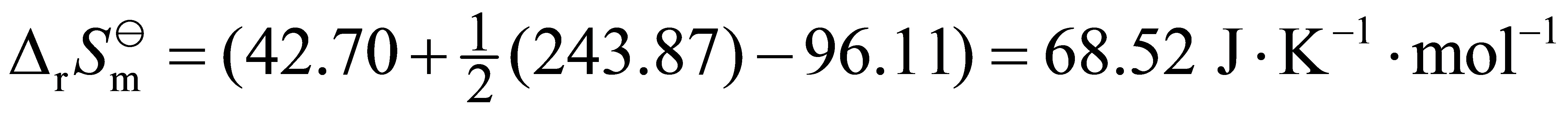
得 E= - 1.105 V
⑵ Qr=TrSm×104 J
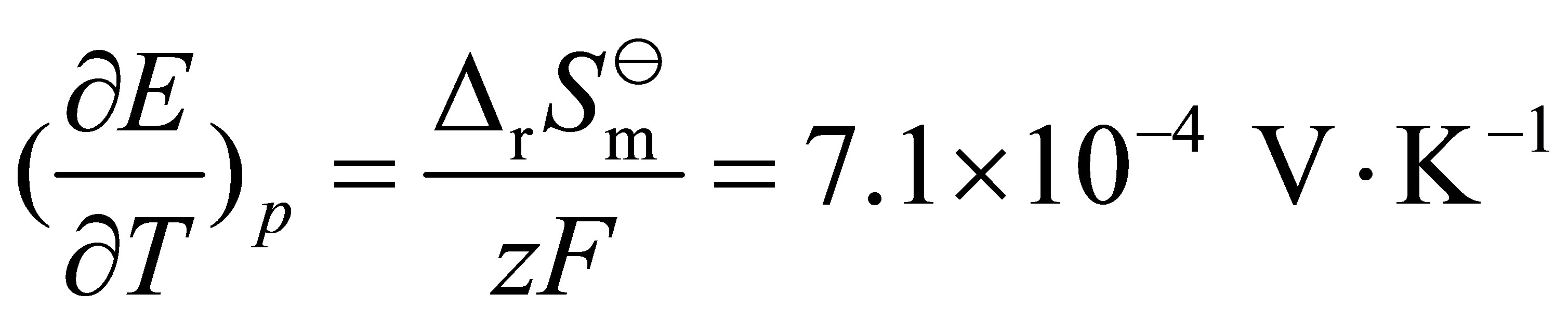
⑶ 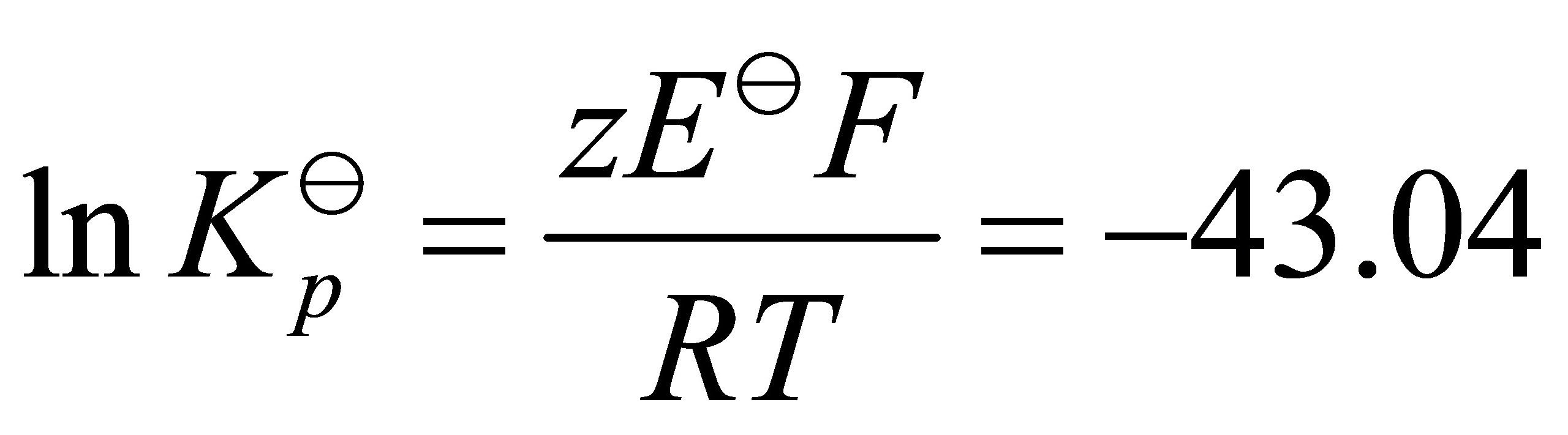 ;
; 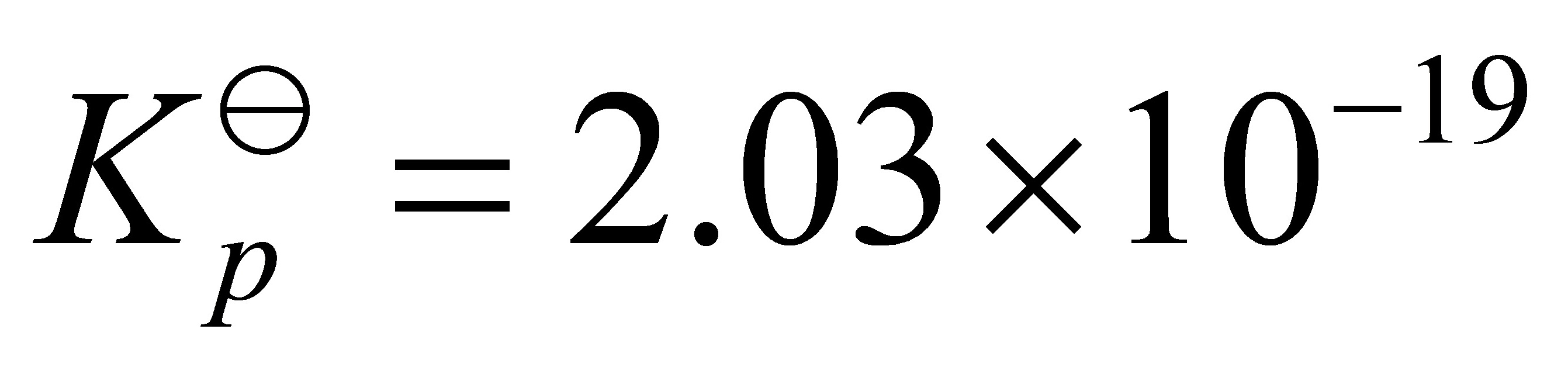 ;
; 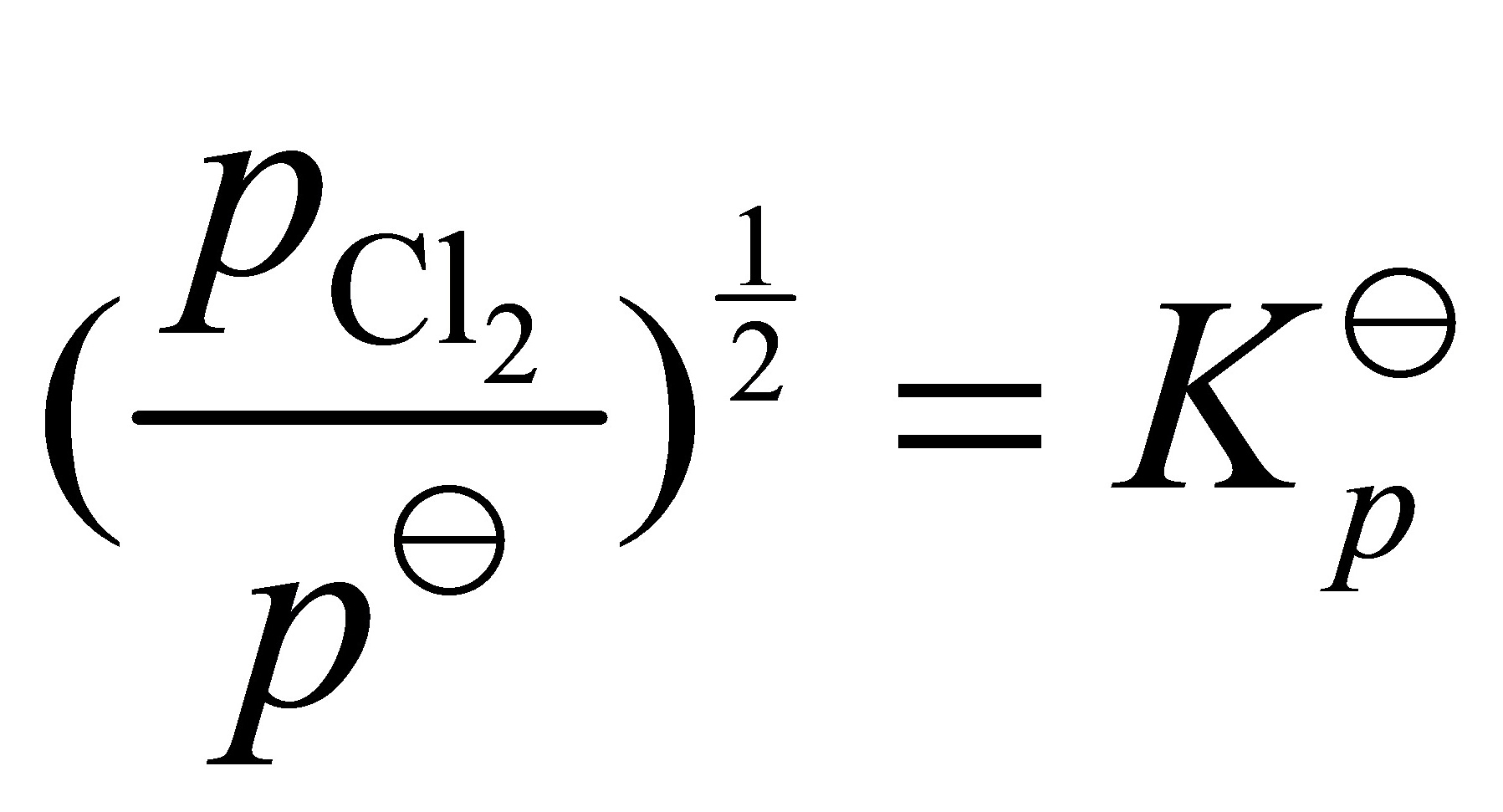
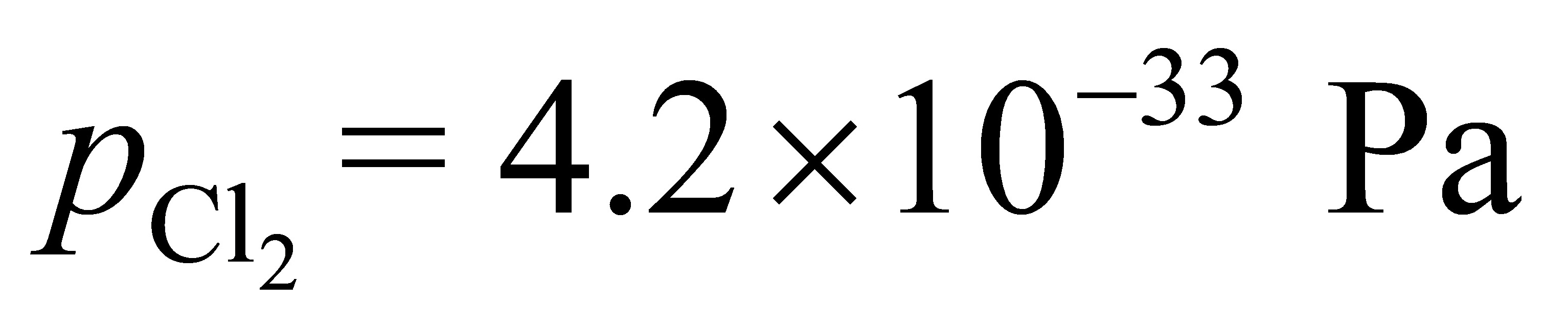
解析
步骤 1:确定电池反应
电池反应为:AgCl(s) → Ag(s) + Cl2(p)
步骤 2:计算电池电动势
电池电动势E = E' - ΔG°/zF,其中E'为标准电极电势,ΔG°为反应的吉布斯自由能变化,z为电子转移数,F为法拉第常数。
步骤 3:计算电动势温度系数
电动势温度系数为(∂E/∂T)p = -ΔS°/zF,其中ΔS°为反应的熵变。
步骤 4:计算有1mol电子电量可逆输出时的热效应
热效应Qr = TΔS°,其中T为温度。
步骤 5:计算AgCl(s)的分解压
分解压P = Kp,其中Kp为平衡常数,Kp = exp(-ΔG°/RT),R为气体常数。
电池反应为:AgCl(s) → Ag(s) + Cl2(p)
步骤 2:计算电池电动势
电池电动势E = E' - ΔG°/zF,其中E'为标准电极电势,ΔG°为反应的吉布斯自由能变化,z为电子转移数,F为法拉第常数。
步骤 3:计算电动势温度系数
电动势温度系数为(∂E/∂T)p = -ΔS°/zF,其中ΔS°为反应的熵变。
步骤 4:计算有1mol电子电量可逆输出时的热效应
热效应Qr = TΔS°,其中T为温度。
步骤 5:计算AgCl(s)的分解压
分解压P = Kp,其中Kp为平衡常数,Kp = exp(-ΔG°/RT),R为气体常数。