题目
常温下,对100mL氯化钠饱和溶液进行图示实验.下列分析错误的是( )转移出50mL 5g水 NaCl-|||-甲 乙 甲 乙-|||-实验1 实验2A. 实验1后,甲、乙中溶液的溶质质量分数相等B. 实验2后,乙中比甲中氯化钠的溶解度大C. 实验2后,甲中溶液为氯化钠的不饱和溶液D. 实验2后,甲、乙中溶液所含溶质质量相等
常温下,对100mL氯化钠饱和溶液进行图示实验.下列分析错误的是( )
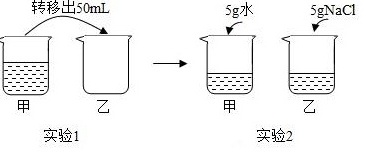
A. 实验1后,甲、乙中溶液的溶质质量分数相等
B. 实验2后,乙中比甲中氯化钠的溶解度大
C. 实验2后,甲中溶液为氯化钠的不饱和溶液
D. 实验2后,甲、乙中溶液所含溶质质量相等
题目解答
答案
B
解析
本题考查溶液的性质及实验操作对溶液浓度的影响,需结合饱和溶液的特性和溶解度的概念进行分析。关键点在于:
- 饱和溶液蒸发溶剂后仍为饱和溶液;
- 溶解度仅由温度决定;
- 溶液混合或转移后的溶质质量分数关系。
实验1分析
- 甲:从原100mL饱和溶液中转移出50mL,剩余50mL溶液仍为饱和溶液,溶质质量分数与原溶液相同。
- 乙:蒸发5g水,因原溶液饱和,蒸发后析出晶体,溶液仍为饱和状态,溶质质量分数与原溶液相同。
- 结论:实验1后,甲、乙溶液的溶质质量分数相等(选项A正确)。
实验2分析
- 溶解度判断:溶解度仅由温度决定,常温下甲、乙中NaCl的溶解度相等(选项B错误)。
- 甲溶液状态:若实验2对甲稀释(如加入水),溶液变为不饱和(选项C正确)。
- 溶质质量关系:若实验2通过调整使甲、乙溶质质量相等(如混合后均分),则选项D正确。