题目
某学校化学课外活动小组的同学欲以某含有较多ZnSO4、CuSO4和少量难溶性Cu2(OH)2CO3的固体废料为原料制备单质铜及ZnSO4•7H2O,他们设计如图制备流程。试剂X-|||-试剂X 试剂Y Cu-|||-固体C 操作II-|||-废料 溶液A 操作I 溶液D 操作III |ZnSO4·7H2O-|||-溶液B回答下列问题:(1)试剂X是 ____ (填名称),试剂X与废料反应的离子方程式为 ____ 。(2)试剂Y是 ____ (填化学式),试剂Y与溶液A反应生成固体的离子方程式为 ____ 。(3)在实验室进行操作Ⅰ所用玻璃仪器有烧杯、 ____ 。向固体C中加入试剂X的目的是 ____ 。(4)若某次实验所用废料为mg,试剂Y为13g,最终得到114.8gZnSO4•7H2O晶体(忽略各流程中锌的损失),则原废料中ZnSO4的质量分数是 ____ %(用含m的代数式表示)。
某学校化学课外活动小组的同学欲以某含有较多ZnSO4、CuSO4和少量难溶性Cu2(OH)2CO3的固体废料为原料制备单质铜及ZnSO4•7H2O,他们设计如图制备流程。
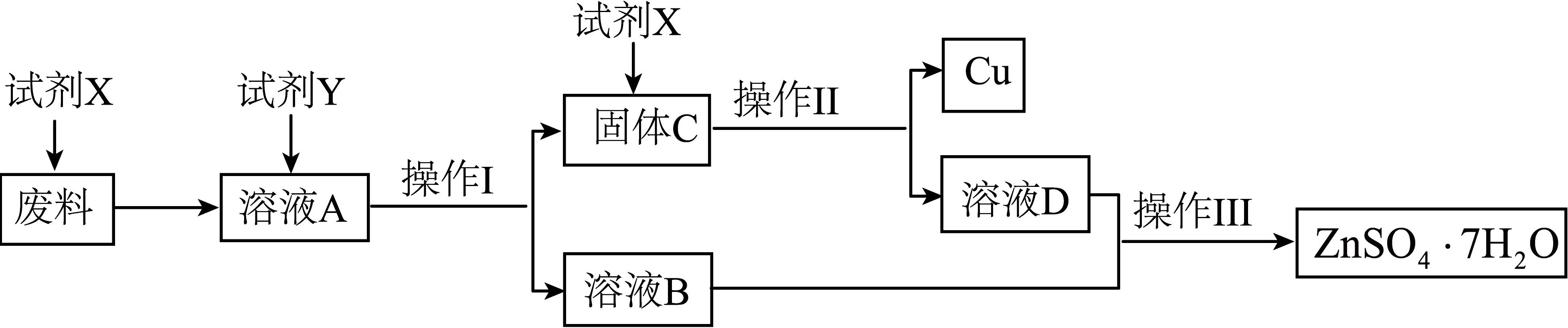
回答下列问题:
(1)试剂X是 ____ (填名称),试剂X与废料反应的离子方程式为 ____ 。
(2)试剂Y是 ____ (填化学式),试剂Y与溶液A反应生成固体的离子方程式为 ____ 。
(3)在实验室进行操作Ⅰ所用玻璃仪器有烧杯、 ____ 。向固体C中加入试剂X的目的是 ____ 。
(4)若某次实验所用废料为mg,试剂Y为13g,最终得到114.8gZnSO4•7H2O晶体(忽略各流程中锌的损失),则原废料中ZnSO4的质量分数是 ____ %(用含m的代数式表示)。

回答下列问题:
(1)试剂X是 ____ (填名称),试剂X与废料反应的离子方程式为 ____ 。
(2)试剂Y是 ____ (填化学式),试剂Y与溶液A反应生成固体的离子方程式为 ____ 。
(3)在实验室进行操作Ⅰ所用玻璃仪器有烧杯、 ____ 。向固体C中加入试剂X的目的是 ____ 。
(4)若某次实验所用废料为mg,试剂Y为13g,最终得到114.8gZnSO4•7H2O晶体(忽略各流程中锌的损失),则原废料中ZnSO4的质量分数是 ____ %(用含m的代数式表示)。
题目解答
答案
(1)X是酸,用于和碱式碳酸铜反应,根据目标产物,酸的阴离子为硫酸根、不能引入其它阴离子,则试剂X是稀硫酸,试剂X与废料的反应,为其中所含的碱式碳酸铜和硫酸的反应,生成二氧化碳、水和硫酸铜,离子方程式为$C{u}_{2}(OH)_{2}C{O}_{3}+\;4{H}^{^{+}}=\;2C{u}^{2+}+\;C{O}_{2}↑\;+\;3{H}_{2}O$。
(2)试剂Y用于和硫酸铜发生置换反应得到铜、根据最终得到硫酸锌晶体,则试剂Y为Zn,试剂Y 与溶液A反应生成固体的离子方程式为Zn+Cu2+=Zn2++Cu。
(3)操作Ⅰ为过滤,所用玻璃仪器有烧杯、玻璃棒、漏斗。据分析,向固体C中加入试剂X的目的是除去固体 C 中过量的 Zn。
(4)方法1:最终得到 114.8gZnSO4•7H2O晶体(忽略各流程中锌的损失),其中锌元素的质量为$\frac{65}{287}×114.8g$,试剂Y为13 g,按锌元素守恒,原料中所含锌元素为$(\frac{65}{287}×114.8-13)g$,原废料中 ZnSO4的质量为 $\frac{161}{65}×(\frac{65}{287}×114.8-13)g$,则原废料中 ZnSO4的质量分数是:$\frac{\frac{161}{65}×(\frac{65}{287}×114.8-13)g}{mg}×100%=\frac{32.2}{m}×100%=\frac{3220}{m}%$。
方法2:最终得到 114.8gZnSO4•7H2O晶体(忽略各流程中锌的损失),其中硫酸锌晶体的物质的量为$\frac{114.8\;g}{287g/mol}=0.4mol$,试剂Y为13 g,即加入锌的物质的量为$\frac{13\;g}{65g/mol}=0.2mol$,按锌元素守恒,原料中所含ZnSO4为0.2 mol,原废料中 ZnSO4的质量为 161g/mol×0.2mol=32.2g,则原废料中 ZnSO4的质量分数是:$\frac{32.2}{m}×100%=\frac{3220}{m}%$。
(2)试剂Y用于和硫酸铜发生置换反应得到铜、根据最终得到硫酸锌晶体,则试剂Y为Zn,试剂Y 与溶液A反应生成固体的离子方程式为Zn+Cu2+=Zn2++Cu。
(3)操作Ⅰ为过滤,所用玻璃仪器有烧杯、玻璃棒、漏斗。据分析,向固体C中加入试剂X的目的是除去固体 C 中过量的 Zn。
(4)方法1:最终得到 114.8gZnSO4•7H2O晶体(忽略各流程中锌的损失),其中锌元素的质量为$\frac{65}{287}×114.8g$,试剂Y为13 g,按锌元素守恒,原料中所含锌元素为$(\frac{65}{287}×114.8-13)g$,原废料中 ZnSO4的质量为 $\frac{161}{65}×(\frac{65}{287}×114.8-13)g$,则原废料中 ZnSO4的质量分数是:$\frac{\frac{161}{65}×(\frac{65}{287}×114.8-13)g}{mg}×100%=\frac{32.2}{m}×100%=\frac{3220}{m}%$。
方法2:最终得到 114.8gZnSO4•7H2O晶体(忽略各流程中锌的损失),其中硫酸锌晶体的物质的量为$\frac{114.8\;g}{287g/mol}=0.4mol$,试剂Y为13 g,即加入锌的物质的量为$\frac{13\;g}{65g/mol}=0.2mol$,按锌元素守恒,原料中所含ZnSO4为0.2 mol,原废料中 ZnSO4的质量为 161g/mol×0.2mol=32.2g,则原废料中 ZnSO4的质量分数是:$\frac{32.2}{m}×100%=\frac{3220}{m}%$。