题目
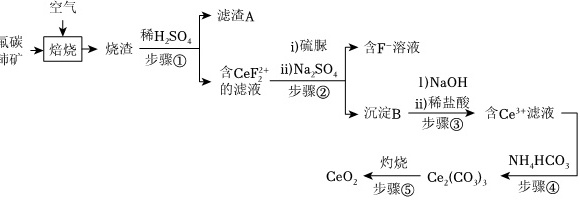
氧化铈(CeO2)是一种应用非常广泛的稀土氧化物。现以氟碳铈矿(含CeFCO3、BaO、SiO2等)为原料制备氧化铈,其工艺流程如图所示:空气-|||- 滤渣A i)硫脲 含 F^- 容液 含 ii)Na2SO 的滤液 CeF2^(2+) 步骤② 1)NaOH 沉淀B ii)稀盐酸 步骤③ 含 Ce^(3+) 滤液 NH4HCO3 CeO2 Ce2C O3}步骤④ -|||-原碳 →-|||-稀H2SO4-|||-市矿 焙烧 → 烧渣 步骤①已知:①稀土离子易与(SO)_(4)^2-形成复盐沉淀,Ce3+和(SO)_(4)^2-发生反应:Ce2(SO4)3+Na2SO4+nH2O═Ce2(SO4)3•Na2SO4•nH2O↓;②硫脲:空气-|||- 滤渣A i)硫脲 含 F^- 容液 含 ii)Na2SO 的滤液 CeF2^(2+) 步骤② 1)NaOH 沉淀B ii)稀盐酸 步骤③ 含 Ce^(3+) 滤液 NH4HCO3 CeO2 Ce2C O3}步骤④ -|||-原碳 →-|||-稀H2SO4-|||-市矿 焙烧 → 烧渣 步骤①具有还原性,酸性条件下易被氧化为(SCN2H3)2;③Ce3+在空气中易被氧化为Ce4+,两者均能形成氢氧化物沉淀;④Ce2(CO3)3为白色粉末,难溶于水。回答下列问题:(1)滤渣A的主要成分是 ____ (填写化学式)。(2)在另一种生产工艺中,在氟碳铈矿矿石粉中加入碳酸氢钠同时通入氧气焙烧,焙烧得到NaF和CeO2两种固体以及两种高温下的气态物质,请写出焙烧过程中相应的化学方程式 ____ 。(3)加入硫脲的目的是将(CeF)_(2)^2+还原为Ce3+,反应的离子方程式为 ____ 。(4)步骤③加入盐酸后,通常还需加入另一种化学试剂X,根据题中信息推测,加入X的作用为 ____ 。(5)下列关于步骤④的说法正确的是 ____ (填字母)。A.过滤后的滤液中仍含有较多Ce3+,需要将滤液循环以提高产率B.可以用Na2CO3溶液代替NH4HCO3溶液,不影响产品纯度C.过滤时选择减压过滤能够大大提高过滤效率D.该步骤发生的反应是2Ce3++6(HCO)_(3)^-═Ce2(CO3)3↓+3CO2↑+3H2O(6)若常温下,Ka2(H2CO3)=5.0×10-11,Ksp(Ce2(CO3)3]=1.0×10-28,Ce3+恰好沉淀完c(Ce3+)=1.0×10-5mol•L-1,此时测得溶液的pH=5,则溶液中c((HCO)_(3)^-)= ____ mol•L-1。
氧化铈(CeO2)是一种应用非常广泛的稀土氧化物。现以氟碳铈矿(含CeFCO3、BaO、SiO2等)为原料制备氧化铈,其工艺流程如图所示:
已知:①稀土离子易与${SO}_{4}^{2-}$形成复盐沉淀,Ce3+和${SO}_{4}^{2-}$发生反应:Ce2(SO4)3+Na2SO4+nH2O═Ce2(SO4)3•Na2SO4•nH2O↓;
②硫脲: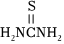 具有还原性,酸性条件下易被氧化为(SCN2H3)2;
具有还原性,酸性条件下易被氧化为(SCN2H3)2;
③Ce3+在空气中易被氧化为Ce4+,两者均能形成氢氧化物沉淀;
④Ce2(CO3)3为白色粉末,难溶于水。
回答下列问题:
(1)滤渣A的主要成分是 ____ (填写化学式)。
(2)在另一种生产工艺中,在氟碳铈矿矿石粉中加入碳酸氢钠同时通入氧气焙烧,焙烧得到NaF和CeO2两种固体以及两种高温下的气态物质,请写出焙烧过程中相应的化学方程式 ____ 。
(3)加入硫脲的目的是将${CeF}_{2}^{2+}$还原为Ce3+,反应的离子方程式为 ____ 。
(4)步骤③加入盐酸后,通常还需加入另一种化学试剂X,根据题中信息推测,加入X的作用为 ____ 。
(5)下列关于步骤④的说法正确的是 ____ (填字母)。
A.过滤后的滤液中仍含有较多Ce3+,需要将滤液循环以提高产率
B.可以用Na2CO3溶液代替NH4HCO3溶液,不影响产品纯度
C.过滤时选择减压过滤能够大大提高过滤效率
D.该步骤发生的反应是2Ce3++6${HCO}_{3}^{-}$═Ce2(CO3)3↓+3CO2↑+3H2O
(6)若常温下,Ka2(H2CO3)=5.0×10-11,Ksp(Ce2(CO3)3]=1.0×10-28,Ce3+恰好沉淀完c(Ce3+)=1.0×10-5mol•L-1,此时测得溶液的pH=5,则溶液中c(${HCO}_{3}^{-}$)= ____ mol•L-1。

已知:①稀土离子易与${SO}_{4}^{2-}$形成复盐沉淀,Ce3+和${SO}_{4}^{2-}$发生反应:Ce2(SO4)3+Na2SO4+nH2O═Ce2(SO4)3•Na2SO4•nH2O↓;
②硫脲:
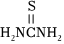 具有还原性,酸性条件下易被氧化为(SCN2H3)2;
具有还原性,酸性条件下易被氧化为(SCN2H3)2;③Ce3+在空气中易被氧化为Ce4+,两者均能形成氢氧化物沉淀;
④Ce2(CO3)3为白色粉末,难溶于水。
回答下列问题:
(1)滤渣A的主要成分是 ____ (填写化学式)。
(2)在另一种生产工艺中,在氟碳铈矿矿石粉中加入碳酸氢钠同时通入氧气焙烧,焙烧得到NaF和CeO2两种固体以及两种高温下的气态物质,请写出焙烧过程中相应的化学方程式 ____ 。
(3)加入硫脲的目的是将${CeF}_{2}^{2+}$还原为Ce3+,反应的离子方程式为 ____ 。
(4)步骤③加入盐酸后,通常还需加入另一种化学试剂X,根据题中信息推测,加入X的作用为 ____ 。
(5)下列关于步骤④的说法正确的是 ____ (填字母)。
A.过滤后的滤液中仍含有较多Ce3+,需要将滤液循环以提高产率
B.可以用Na2CO3溶液代替NH4HCO3溶液,不影响产品纯度
C.过滤时选择减压过滤能够大大提高过滤效率
D.该步骤发生的反应是2Ce3++6${HCO}_{3}^{-}$═Ce2(CO3)3↓+3CO2↑+3H2O
(6)若常温下,Ka2(H2CO3)=5.0×10-11,Ksp(Ce2(CO3)3]=1.0×10-28,Ce3+恰好沉淀完c(Ce3+)=1.0×10-5mol•L-1,此时测得溶液的pH=5,则溶液中c(${HCO}_{3}^{-}$)= ____ mol•L-1。
题目解答
答案
解:(1)SiO2不反应,BaO与硫酸反应生成BaSO4沉淀,滤渣A是 BaSO4和SiO2,
故答案为:BaSO4和SiO2;
(2)在另一种生产工艺中,在氟碳铈矿矿石粉中加入碳酸氢钠同时通入氧气焙烧,焙烧得到NaF和CeO2两种固体以及两种高温下的气态物质为CO2、H2O,焙烧过程中相应的化学方程式4CeFCO3+4NaHCO3+O2$\frac{\underline{\;高温\;}}{\;}$4NaF+4GeO2+8CO2+2H2O,
故答案为:4CeFCO3+4NaHCO3+O2$\frac{\underline{\;高温\;}}{\;}$4NaF+4GeO2+8CO2+2H2O;
(3)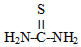 具有还原性,酸性条件下将还原为Ce3+,自身被以为(SCN2H3)2,反应方程式为:2${CeF}_{2}^{2-}$+2
具有还原性,酸性条件下将还原为Ce3+,自身被以为(SCN2H3)2,反应方程式为:2${CeF}_{2}^{2-}$+2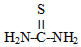 =2Ce3++(SCN2H3)2+2HF+2F-,
=2Ce3++(SCN2H3)2+2HF+2F-,
故答案为:2${CeF}_{2}^{2-}$+2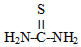 =2Ce3++(SCN2H3)2+2HF+2F-;
=2Ce3++(SCN2H3)2+2HF+2F-;
(4)步骤③加入盐酸后,通常还需加入另一种化学试剂X,作用为防止Ce3+被空气氧化,
故答案为:防止Ce3+被空气氧化;
(5)A.由于加入的碳酸氢铵过量,沉淀比较充分,因此过滤后的滤液中含有的Ce3+很少,故A错误;
B.碳酸钠与Ce3+直接快速反应沉淀,在生成沉淀的过程中,其他杂质离子会掺杂在沉淀中,因此不可以用Na2CO3溶液代替NH4HCO3溶液,会影响产品纯度,故B错误;
C.减压过滤能够大大提高过滤效率,故C正确;
D.Ce3+加入碳酸氢铵反应生成Ce2(CO3)3沉淀,同时生成二氧化碳和水,则该步骤发生的反应是2Ce3++6${HCO}_{3}^{-}$=Ce2(CO3)3↓+3CO2↑+3H2O,故D正确;
故答案为:CD;
(6)步骤④中若Ce3+恰好沉淀完全c(Ce3+)为1.0×10-5mol•L-1,K sp [Ce2(CO3)3]=1.0×10-28=c2(Ce3+)c3(${CO}_{3}^{2-}$)=(1.0×10-5)2×c3(${CO}_{3}^{2-}$),c(${CO}_{3}^{2-}$)=1.0×10-6,此时测得溶液的,pH=5,K a2 (H2CO3)=5.0×10-11=$\frac{c(C{O}_{3}^{2-})×c({H}^{+})}{c(HC{O}_{3}^{-})}$=$\frac{1.0×1{0}^{-6}×1.0×1{0}^{-5}}{c(HC{O}_{3}^{-})}$,则溶液中c(${HCO}_{3}^{-}$)=0.2mol•L-1,
故答案为:0.2;
故答案为:BaSO4和SiO2;
(2)在另一种生产工艺中,在氟碳铈矿矿石粉中加入碳酸氢钠同时通入氧气焙烧,焙烧得到NaF和CeO2两种固体以及两种高温下的气态物质为CO2、H2O,焙烧过程中相应的化学方程式4CeFCO3+4NaHCO3+O2$\frac{\underline{\;高温\;}}{\;}$4NaF+4GeO2+8CO2+2H2O,
故答案为:4CeFCO3+4NaHCO3+O2$\frac{\underline{\;高温\;}}{\;}$4NaF+4GeO2+8CO2+2H2O;
(3)
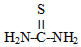 具有还原性,酸性条件下将还原为Ce3+,自身被以为(SCN2H3)2,反应方程式为:2${CeF}_{2}^{2-}$+2
具有还原性,酸性条件下将还原为Ce3+,自身被以为(SCN2H3)2,反应方程式为:2${CeF}_{2}^{2-}$+2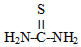 =2Ce3++(SCN2H3)2+2HF+2F-,
=2Ce3++(SCN2H3)2+2HF+2F-,故答案为:2${CeF}_{2}^{2-}$+2
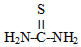 =2Ce3++(SCN2H3)2+2HF+2F-;
=2Ce3++(SCN2H3)2+2HF+2F-;(4)步骤③加入盐酸后,通常还需加入另一种化学试剂X,作用为防止Ce3+被空气氧化,
故答案为:防止Ce3+被空气氧化;
(5)A.由于加入的碳酸氢铵过量,沉淀比较充分,因此过滤后的滤液中含有的Ce3+很少,故A错误;
B.碳酸钠与Ce3+直接快速反应沉淀,在生成沉淀的过程中,其他杂质离子会掺杂在沉淀中,因此不可以用Na2CO3溶液代替NH4HCO3溶液,会影响产品纯度,故B错误;
C.减压过滤能够大大提高过滤效率,故C正确;
D.Ce3+加入碳酸氢铵反应生成Ce2(CO3)3沉淀,同时生成二氧化碳和水,则该步骤发生的反应是2Ce3++6${HCO}_{3}^{-}$=Ce2(CO3)3↓+3CO2↑+3H2O,故D正确;
故答案为:CD;
(6)步骤④中若Ce3+恰好沉淀完全c(Ce3+)为1.0×10-5mol•L-1,K sp [Ce2(CO3)3]=1.0×10-28=c2(Ce3+)c3(${CO}_{3}^{2-}$)=(1.0×10-5)2×c3(${CO}_{3}^{2-}$),c(${CO}_{3}^{2-}$)=1.0×10-6,此时测得溶液的,pH=5,K a2 (H2CO3)=5.0×10-11=$\frac{c(C{O}_{3}^{2-})×c({H}^{+})}{c(HC{O}_{3}^{-})}$=$\frac{1.0×1{0}^{-6}×1.0×1{0}^{-5}}{c(HC{O}_{3}^{-})}$,则溶液中c(${HCO}_{3}^{-}$)=0.2mol•L-1,
故答案为:0.2;