题目
已知 φθ(MnO4-/Mn2+) = 1.51V, φθ(Cl2/Cl-) = 1.36V,若将此两电对组成电池, 请写出: (1) 该电池的电池符号; (2) 写出电池反应以及电池标准电动势; (3) 计算电池反应在25℃时 ΔrGm和K ; (4) 当[H+] = 1.0×10-2 mol·L-1,而其他离子浓度均为1.0 mol·L-1, p(Cl2)= 100 kPa 时的电池电动势; (5) 在(4)的情况下,K和 ΔrGm各是多少?
已知 φθ(MnO4-/Mn2+) = 1.51V, φθ(Cl2/Cl-) = 1.36V,若将此两电对组成电池, 请写出: (1) 该电池的电池符号; (2) 写出电池反应以及电池标准电动势; (3) 计算电池反应在25℃时 ΔrGm和K ; (4) 当[H+] = 1.0×10-2 mol·L-1,而其他离子浓度均为1.0 mol·L-1, p(Cl2)= 100 kPa 时的电池电动势; (5) 在(4)的情况下,K和 ΔrGm各是多少?
题目解答
答案
解:(1) Pt, Cl2(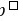 )┃Cl- (1.0 mol·L-1)‖
)┃Cl- (1.0 mol·L-1)‖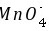 (1.0 mol·L-1), Mn2+ (1.0 mol·L-1), H+ (1.0 mol·L-1)┃Pt
(1.0 mol·L-1), Mn2+ (1.0 mol·L-1), H+ (1.0 mol·L-1)┃Pt
(2) 电池反应: 2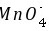 + 10Cl-+ 16H+ = 2Mn2+ + 5Cl2 + 8H2O
+ 10Cl-+ 16H+ = 2Mn2+ + 5Cl2 + 8H2O
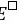 =
=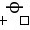 –
–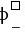 = 1.51- 1.36 = 0.15 (V)
= 1.51- 1.36 = 0.15 (V)
(3) 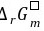 = -
= -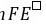 = -10×96.5×0.15 = -1.4×102 (kJ﹒mol-1)
= -10×96.5×0.15 = -1.4×102 (kJ﹒mol-1)
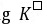 =
=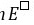 / 0.0592 = (10×0.15) / 0.0592 = 25.34,
/ 0.0592 = (10×0.15) / 0.0592 = 25.34,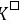 = 2.2×1025
= 2.2×1025
(4) 正极: 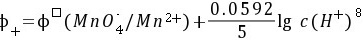
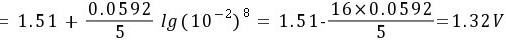
负极: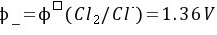
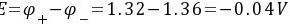
(5) K不变
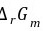 = -nFE = -10×96.5 (-0.04) = 38.6 (kJ·mol-1)
= -nFE = -10×96.5 (-0.04) = 38.6 (kJ·mol-1)
解析
步骤 1:确定电池符号
根据电对的电极电势,MnO4-/Mn2+ 的电极电势较高,因此它作为正极,Cl2/Cl- 作为负极。电池符号为:Pt, Cl2()┃Cl- (1.0 mol·L-1)‖${Mn{O}_{4}}^{-}$(1.0 mol·L-1), Mn2+ (1.0 mol·L-1), H+ (1.0 mol·L-1)┃Pt。
步骤 2:写出电池反应及标准电动势
电池反应为:2${Mn{O}_{4}}^{-}$+ 10Cl-+ 16H+ = 2Mn2+ + 5Cl2 + 8H2O。标准电动势为:=+6 – = 1.51- 1.36 = 0.15 (V)。
步骤 3:计算 ΔrGm 和 K
ΔrGm = -$1FE$ 口= -10×96.5×0.15 = -1.4×102 (kJ﹒mol-1)。K口= 2.2×1025。
步骤 4:计算电池电动势
正极:${p}_{f}={\phi }^{7}(Mn{O}_{4}/{Mn}^{2+})+\dfrac {0.0592}{5}\lg c{({H}^{+})}^{8}$ =1.51+$\dfrac {0.0592}{5}\lg {({10}^{-2})}^{8}$=1.51$\cdot \dfrac {16\times 0.0592}{5}$=1.32V。负极:p $=\phi ({Cl}_{2}/Cl)=1.36V$。$=\varphi +\varphi =1.32-1.36=-0.04V$。
步骤 5:计算 ΔrGm
K不变。= -nFE = -10×96.5 (-0.04) = 38.6 (kJ·mol-1)。
根据电对的电极电势,MnO4-/Mn2+ 的电极电势较高,因此它作为正极,Cl2/Cl- 作为负极。电池符号为:Pt, Cl2()┃Cl- (1.0 mol·L-1)‖${Mn{O}_{4}}^{-}$(1.0 mol·L-1), Mn2+ (1.0 mol·L-1), H+ (1.0 mol·L-1)┃Pt。
步骤 2:写出电池反应及标准电动势
电池反应为:2${Mn{O}_{4}}^{-}$+ 10Cl-+ 16H+ = 2Mn2+ + 5Cl2 + 8H2O。标准电动势为:=+6 – = 1.51- 1.36 = 0.15 (V)。
步骤 3:计算 ΔrGm 和 K
ΔrGm = -$1FE$ 口= -10×96.5×0.15 = -1.4×102 (kJ﹒mol-1)。K口= 2.2×1025。
步骤 4:计算电池电动势
正极:${p}_{f}={\phi }^{7}(Mn{O}_{4}/{Mn}^{2+})+\dfrac {0.0592}{5}\lg c{({H}^{+})}^{8}$ =1.51+$\dfrac {0.0592}{5}\lg {({10}^{-2})}^{8}$=1.51$\cdot \dfrac {16\times 0.0592}{5}$=1.32V。负极:p $=\phi ({Cl}_{2}/Cl)=1.36V$。$=\varphi +\varphi =1.32-1.36=-0.04V$。
步骤 5:计算 ΔrGm
K不变。= -nFE = -10×96.5 (-0.04) = 38.6 (kJ·mol-1)。