题目
4.在 .5mol/L (H)_(2)S(O)_(4) 介质中,等体积的 .60mol/(L)^-(Fe)^2+ 溶液与 .20mol/L(Ce)^4+ 溶液混合。-|||-反应达到平衡后, ^4+ 的浓度为多少?

题目解答
答案
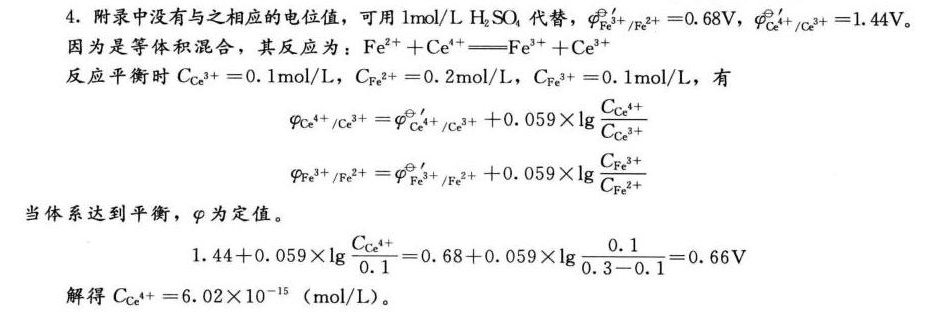
解析
步骤 1:确定反应方程式
反应方程式为:${Fe}^{2+} + {Ce}^{4+} \rightarrow {Fe}^{3+} + {Ce}^{3+}$
步骤 2:计算反应物的初始浓度
由于是等体积混合,反应物的初始浓度为:
${C}_{{Fe}^{2+}} = 0.60 mol/L / 2 = 0.30 mol/L$
${C}_{{Ce}^{4+}} = 0.20 mol/L / 2 = 0.10 mol/L$
步骤 3:计算反应平衡时的浓度
设反应平衡时,${Fe}^{2+}$ 和 ${Ce}^{4+}$ 的浓度分别为 ${C}_{{Fe}^{2+}}$ 和 ${C}_{{Ce}^{4+}}$,${Fe}^{3+}$ 和 ${Ce}^{3+}$ 的浓度分别为 ${C}_{{Fe}^{3+}}$ 和 ${C}_{{Ce}^{3+}}$。
根据反应方程式,反应平衡时,${C}_{{Fe}^{3+}} = {C}_{{Ce}^{3+}} = 0.10 mol/L$,${C}_{{Fe}^{2+}} = 0.30 mol/L - 0.10 mol/L = 0.20 mol/L$,${C}_{{Ce}^{4+}} = 0.10 mol/L - 0.10 mol/L = 0 mol/L$。
步骤 4:计算反应平衡时的电位
根据能斯特方程,反应平衡时的电位为:
$4{Ce}^{4+}/{Ce}^{3+} = 4{Ce}^{4+}/{Ce}^{3+} + 0.059 \times \lg \dfrac{{C}_{{Ce}^{3+}}}{{C}_{{Ce}^{4+}}}$
$4{Fe}^{3+}/{Fe}^{2+} = 4{Fe}^{3+}/{Fe}^{2+} + 0.059 \times \lg \dfrac{{C}_{{Fe}^{3+}}}{{C}_{{Fe}^{2+}}}$
当体系达到平衡,φ为定值。
$1.44 + 0.059 \times \lg \dfrac{0.10}{0} = 0.68 + 0.059 \times \lg \dfrac{0.10}{0.20}$
解得 ${C}_{{Ce}^{4+}} = 6.02 \times {10}^{-15} mol/L$。
反应方程式为:${Fe}^{2+} + {Ce}^{4+} \rightarrow {Fe}^{3+} + {Ce}^{3+}$
步骤 2:计算反应物的初始浓度
由于是等体积混合,反应物的初始浓度为:
${C}_{{Fe}^{2+}} = 0.60 mol/L / 2 = 0.30 mol/L$
${C}_{{Ce}^{4+}} = 0.20 mol/L / 2 = 0.10 mol/L$
步骤 3:计算反应平衡时的浓度
设反应平衡时,${Fe}^{2+}$ 和 ${Ce}^{4+}$ 的浓度分别为 ${C}_{{Fe}^{2+}}$ 和 ${C}_{{Ce}^{4+}}$,${Fe}^{3+}$ 和 ${Ce}^{3+}$ 的浓度分别为 ${C}_{{Fe}^{3+}}$ 和 ${C}_{{Ce}^{3+}}$。
根据反应方程式,反应平衡时,${C}_{{Fe}^{3+}} = {C}_{{Ce}^{3+}} = 0.10 mol/L$,${C}_{{Fe}^{2+}} = 0.30 mol/L - 0.10 mol/L = 0.20 mol/L$,${C}_{{Ce}^{4+}} = 0.10 mol/L - 0.10 mol/L = 0 mol/L$。
步骤 4:计算反应平衡时的电位
根据能斯特方程,反应平衡时的电位为:
$4{Ce}^{4+}/{Ce}^{3+} = 4{Ce}^{4+}/{Ce}^{3+} + 0.059 \times \lg \dfrac{{C}_{{Ce}^{3+}}}{{C}_{{Ce}^{4+}}}$
$4{Fe}^{3+}/{Fe}^{2+} = 4{Fe}^{3+}/{Fe}^{2+} + 0.059 \times \lg \dfrac{{C}_{{Fe}^{3+}}}{{C}_{{Fe}^{2+}}}$
当体系达到平衡,φ为定值。
$1.44 + 0.059 \times \lg \dfrac{0.10}{0} = 0.68 + 0.059 \times \lg \dfrac{0.10}{0.20}$
解得 ${C}_{{Ce}^{4+}} = 6.02 \times {10}^{-15} mol/L$。