题目
25℃ 10 kPa时,1 mol H2完全燃烧生成液态水,-|||-放出285.8 kJ的热量,表示H2燃烧热的化学方程式-|||-为 __ e

题目解答
答案
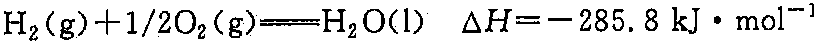
解析
步骤 1:理解燃烧热的定义
燃烧热是指在标准条件下(25℃,101.325 kPa),1 mol 物质完全燃烧生成稳定氧化物时所放出的热量。对于氢气(H2),其燃烧产物是液态水(H2O)。
步骤 2:写出氢气燃烧的化学方程式
氢气燃烧的化学方程式为:${H}_{2}(g) + \frac{1}{2}{O}_{2}(g) \rightarrow {H}_{2}O(l)$
步骤 3:确定燃烧热的数值
题目中给出1 mol H2完全燃烧生成液态水放出285.8 kJ的热量,因此燃烧热的数值为-285.8 kJ/mol。
燃烧热是指在标准条件下(25℃,101.325 kPa),1 mol 物质完全燃烧生成稳定氧化物时所放出的热量。对于氢气(H2),其燃烧产物是液态水(H2O)。
步骤 2:写出氢气燃烧的化学方程式
氢气燃烧的化学方程式为:${H}_{2}(g) + \frac{1}{2}{O}_{2}(g) \rightarrow {H}_{2}O(l)$
步骤 3:确定燃烧热的数值
题目中给出1 mol H2完全燃烧生成液态水放出285.8 kJ的热量,因此燃烧热的数值为-285.8 kJ/mol。