题目
已知氯气与强碱溶液反应时,生成的产物受温度的影响。实验室中利用如图1装置(部分装置省略)制备KClO3和NaClO,并探究其氧化还原性质。-a-|||-MnO2 KOH-|||-水-|||-粉末 溶液-|||-下 NaOH-|||-冰水- 溶液-|||-A B C D E-|||-图1回答下列问题:(1)仪器a的名称是_______。(2)装置A产生氯气的化学方程式为_______。(3)装置B中的试剂为_______,该装置作用为_______。(4)装置C采用的加热方式是_______,装置D中发生反应的离子方程式为_______。(5)装置E的作用是_______,可选用试剂_______。(填标号)a.NaCl溶液b.NaOH溶液c.稀硫酸(6)探究KClO3和NaClO的氧化能力(图2)-a-|||-MnO2 KOH-|||-水-|||-粉末 溶液-|||-下 NaOH-|||-冰水- 溶液-|||-A B C D E-|||-图1操作:向1号(KClO3)和2号(NaClO)试管中,滴加中性KI溶液。现象:1号试管溶液颜色不变,2号试管溶液变为棕色。结论:该条件下氧化能力KClO3_______NaClO。(填“大于”或“小于”)(7)工业上常用氯碱工业来制备氯气,其原理为电解饱和食盐水,生成氯气的同时还可得到氢气和烧碱,请写出该反应的离子方程式_______。
已知氯气与强碱溶液反应时,生成的产物受温度的影响。实验室中利用如图1装置(部分装置省略)制备KClO3和NaClO,并探究其氧化还原性质。
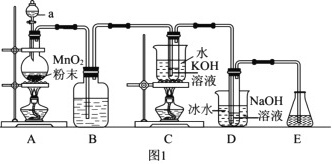
回答下列问题:
(1)仪器a的名称是_______。
(2)装置A产生氯气的化学方程式为_______。
(3)装置B中的试剂为_______,该装置作用为_______。
(4)装置C采用的加热方式是_______,装置D中发生反应的离子方程式为_______。
(5)装置E的作用是_______,可选用试剂_______。(填标号)
a.NaCl溶液b.NaOH溶液c.稀硫酸
(6)探究KClO3和NaClO的氧化能力(图2)
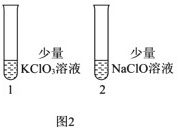
操作:向1号(KClO3)和2号(NaClO)试管中,滴加中性KI溶液。
现象:1号试管溶液颜色不变,2号试管溶液变为棕色。
结论:该条件下氧化能力KClO3_______NaClO。(填“大于”或“小于”)
(7)工业上常用氯碱工业来制备氯气,其原理为电解饱和食盐水,生成氯气的同时还可得到氢气和烧碱,请写出该反应的离子方程式_______。

回答下列问题:
(1)仪器a的名称是_______。
(2)装置A产生氯气的化学方程式为_______。
(3)装置B中的试剂为_______,该装置作用为_______。
(4)装置C采用的加热方式是_______,装置D中发生反应的离子方程式为_______。
(5)装置E的作用是_______,可选用试剂_______。(填标号)
a.NaCl溶液b.NaOH溶液c.稀硫酸
(6)探究KClO3和NaClO的氧化能力(图2)

操作:向1号(KClO3)和2号(NaClO)试管中,滴加中性KI溶液。
现象:1号试管溶液颜色不变,2号试管溶液变为棕色。
结论:该条件下氧化能力KClO3_______NaClO。(填“大于”或“小于”)
(7)工业上常用氯碱工业来制备氯气,其原理为电解饱和食盐水,生成氯气的同时还可得到氢气和烧碱,请写出该反应的离子方程式_______。
题目解答
答案

解析
步骤 1:仪器a的名称
仪器a是分液漏斗,用于滴加液体。
步骤 2:装置A产生氯气的化学方程式
装置A中,二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水。
步骤 3:装置B中的试剂及作用
装置B中,饱和食盐水用于除去氯气中的氯化氢气体。
步骤 4:装置C的加热方式
装置C采用水浴加热,以控制反应温度。
步骤 5:装置D中发生反应的离子方程式
装置D中,氯气与氢氧化钠溶液反应生成氯离子、次氯酸根离子和水。
步骤 6:装置E的作用及选用试剂
装置E用于吸收尾气氯气,防止污染环境,选用NaOH溶液吸收氯气。
步骤 7:探究KClO3和NaClO的氧化能力
向1号(KClO3)和2号(NaClO)试管中,滴加中性KI溶液,1号试管溶液颜色不变,2号试管溶液变为棕色,说明NaClO的氧化能力大于KClO3。
步骤 8:电解饱和食盐水的离子方程式
电解饱和食盐水,生成氯气、氢气和氢氧化钠。
仪器a是分液漏斗,用于滴加液体。
步骤 2:装置A产生氯气的化学方程式
装置A中,二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水。
步骤 3:装置B中的试剂及作用
装置B中,饱和食盐水用于除去氯气中的氯化氢气体。
步骤 4:装置C的加热方式
装置C采用水浴加热,以控制反应温度。
步骤 5:装置D中发生反应的离子方程式
装置D中,氯气与氢氧化钠溶液反应生成氯离子、次氯酸根离子和水。
步骤 6:装置E的作用及选用试剂
装置E用于吸收尾气氯气,防止污染环境,选用NaOH溶液吸收氯气。
步骤 7:探究KClO3和NaClO的氧化能力
向1号(KClO3)和2号(NaClO)试管中,滴加中性KI溶液,1号试管溶液颜色不变,2号试管溶液变为棕色,说明NaClO的氧化能力大于KClO3。
步骤 8:电解饱和食盐水的离子方程式
电解饱和食盐水,生成氯气、氢气和氢氧化钠。