题目
1、某元素的价电子构型为3d^104s^2,该元素的原子序数为 __ 该元素位于周期表-|||-的第 __ 族,。-|||-__

题目解答
答案
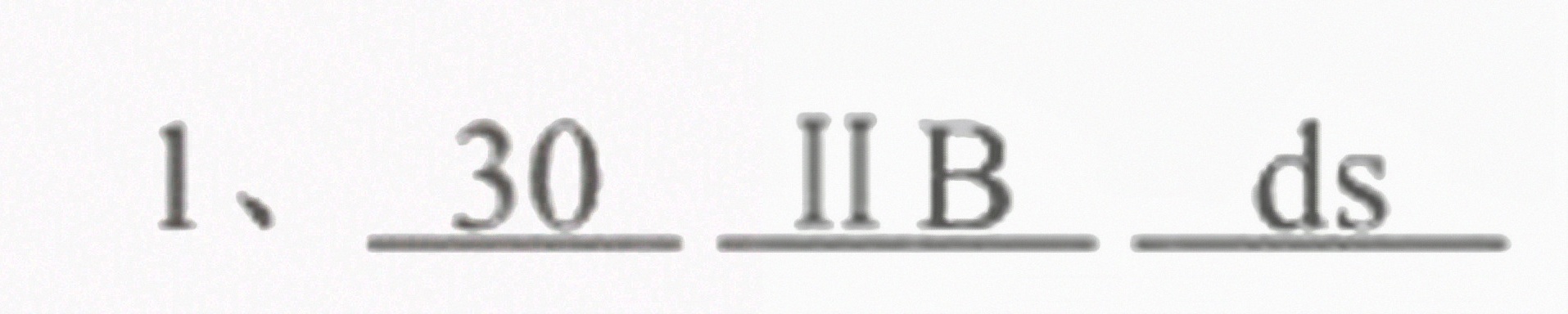
解析
步骤 1:确定价电子构型
价电子构型为3d^104s^2,表示该元素的价电子排布在3d和4s轨道上,其中3d轨道全满,4s轨道有两个电子。
步骤 2:计算原子序数
根据价电子构型,3d轨道全满有10个电子,4s轨道有2个电子,因此价电子总数为12个。考虑到3d轨道的电子数,该元素的原子序数为18(1s^22s^22p^63s^23p^6)加上12个价电子,即18+12=30。
步骤 3:确定元素在周期表中的位置
根据价电子构型3d^104s^2,该元素属于过渡金属,位于周期表的第11族(IB族),且属于ds区。
价电子构型为3d^104s^2,表示该元素的价电子排布在3d和4s轨道上,其中3d轨道全满,4s轨道有两个电子。
步骤 2:计算原子序数
根据价电子构型,3d轨道全满有10个电子,4s轨道有2个电子,因此价电子总数为12个。考虑到3d轨道的电子数,该元素的原子序数为18(1s^22s^22p^63s^23p^6)加上12个价电子,即18+12=30。
步骤 3:确定元素在周期表中的位置
根据价电子构型3d^104s^2,该元素属于过渡金属,位于周期表的第11族(IB族),且属于ds区。