题目
煤炭地下气化可将煤高效转化为富含氢气的煤气,H2主要通过水蒸气的还原析氢得到。反应如下(温度为T0):反应ⅰC(s)+H2O(g)⇌H2(g)+CO(g) Δ(H)_(1)=+131.5kJ•mo(l)^-1 K1反应ⅱCO(g)+H2O(g)⇌H2(g)+CO2(g) Δ(H)_(2)=-41.0kJ•mo(l)^-1 K2回答下列问题:(1)写出反应ⅰ平衡常数的表达式:K1= ____ 。(2)反应C(s)+2H2O(g)⇌2H2(g)+CO2(g)的ΔH= ____ kJ•mol-1,平衡常数K= ____ (用含K1、K2的代数式表示)。(3)氧交换机理常用于描述反应ⅰ的历程,包含如图所示两个过程,过程1为活性炭位C吸附H2O(g)形成碳氧复合物C(O),补充该过程的化学方程式:H2O+C= ____ +C(O)。过程1 过程2-|||-90 bigcirc -|||-bigcirc ○□ooo =00 bigcirc -|||-bigcirc ○○一。 bigcirc -|||-bigcirc C OH(4)温度为T0时,在恒容密闭容器中模拟水蒸气的还原析氢过程,下列说法正确的是 ____ 。A.适当减小压强能提高水蒸气的平衡转化率B.增加煤炭可以提高H2的平衡产率C.向容器内充入He可提高反应速率D.选择合适催化剂可以提高H2在单位时间内的产量(5)还原析氢过程中,煤层地下水含量过高会降低反应区温度,影响平衡时煤气(主要包含H2、CO与CO2)组成。煤气组成与煤层地下水含量的关系如图,曲线a是H2,曲线b是 ____ 。煤层地下水含量>0.3%时,H2占有量随煤层地下水含量增大逐渐 ____ (填“增大”、“减小”或“不变”),原因是 ____ 。过程1 过程2-|||-90 bigcirc -|||-bigcirc ○□ooo =00 bigcirc -|||-bigcirc ○○一。 bigcirc -|||-bigcirc C OH
煤炭地下气化可将煤高效转化为富含氢气的煤气,H2主要通过水蒸气的还原析氢得到。反应如下(温度为T0):
反应ⅰC(s)+H2O(g)⇌H2(g)+CO(g) $Δ{H}_{1}=+131.5kJ•mo{l}^{-1}$ K1
反应ⅱCO(g)+H2O(g)⇌H2(g)+CO2(g) $Δ{H}_{2}=-41.0kJ•mo{l}^{-1}$ K2
回答下列问题:
(1)写出反应ⅰ平衡常数的表达式:K1= ____ 。
(2)反应C(s)+2H2O(g)⇌2H2(g)+CO2(g)的ΔH= ____ kJ•mol-1,平衡常数K= ____ (用含K1、K2的代数式表示)。
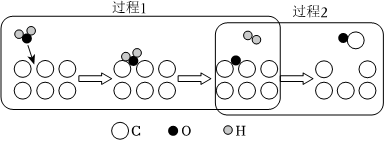
(3)氧交换机理常用于描述反应ⅰ的历程,包含如图所示两个过程,过程1为活性炭位C吸附H2O(g)形成碳氧复合物C(O),补充该过程的化学方程式:H2O+C= ____ +C(O)。
(4)温度为T0时,在恒容密闭容器中模拟水蒸气的还原析氢过程,下列说法正确的是 ____ 。
A.适当减小压强能提高水蒸气的平衡转化率
B.增加煤炭可以提高H2的平衡产率
C.向容器内充入He可提高反应速率
D.选择合适催化剂可以提高H2在单位时间内的产量
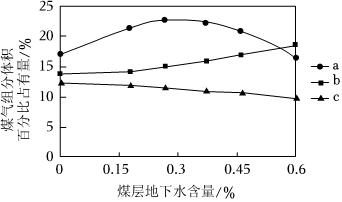
(5)还原析氢过程中,煤层地下水含量过高会降低反应区温度,影响平衡时煤气(主要包含H2、CO与CO2)组成。煤气组成与煤层地下水含量的关系如图,曲线a是H2,曲线b是 ____ 。煤层地下水含量>0.3%时,H2占有量随煤层地下水含量增大逐渐 ____ (填“增大”、“减小”或“不变”),原因是 ____ 。
反应ⅰC(s)+H2O(g)⇌H2(g)+CO(g) $Δ{H}_{1}=+131.5kJ•mo{l}^{-1}$ K1
反应ⅱCO(g)+H2O(g)⇌H2(g)+CO2(g) $Δ{H}_{2}=-41.0kJ•mo{l}^{-1}$ K2
回答下列问题:
(1)写出反应ⅰ平衡常数的表达式:K1= ____ 。
(2)反应C(s)+2H2O(g)⇌2H2(g)+CO2(g)的ΔH= ____ kJ•mol-1,平衡常数K= ____ (用含K1、K2的代数式表示)。
(3)氧交换机理常用于描述反应ⅰ的历程,包含如图所示两个过程,过程1为活性炭位C吸附H2O(g)形成碳氧复合物C(O),补充该过程的化学方程式:H2O+C= ____ +C(O)。

(4)温度为T0时,在恒容密闭容器中模拟水蒸气的还原析氢过程,下列说法正确的是 ____ 。
A.适当减小压强能提高水蒸气的平衡转化率
B.增加煤炭可以提高H2的平衡产率
C.向容器内充入He可提高反应速率
D.选择合适催化剂可以提高H2在单位时间内的产量
(5)还原析氢过程中,煤层地下水含量过高会降低反应区温度,影响平衡时煤气(主要包含H2、CO与CO2)组成。煤气组成与煤层地下水含量的关系如图,曲线a是H2,曲线b是 ____ 。煤层地下水含量>0.3%时,H2占有量随煤层地下水含量增大逐渐 ____ (填“增大”、“减小”或“不变”),原因是 ____ 。

题目解答
答案
解:(1)化学反应平衡常数等于生成物浓度幂之积除以反应物浓度幂之积,则反应ⅰ平衡常数的表达式:${K}_{1}=\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$,
故答案为:$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$;
(2)反应ⅰ+反应ⅱ得:C(s)+2H2O(g)⇌2H2(g)+CO2(g),则ΔH=+131.5kJ•mol-1+(-41.0kJ•mol-1)=+90.5kJ•mol-1;根据盖斯定律可知,反应方程式相加,反应平衡常数相乘,则反应C(s)+2H2O(g)⇌2H2(g)+CO2(g) K=K1•K2,
故答案为:+90.5;K1•K2;
(3)根据题意,结合元素守恒可知应该补充H2,
故答案为:H2;
(4)A.减小压强,平衡向气体减少的方向移动,适当减小压强能使反应i正向移动,反应ii不移动,能提高水蒸气的平衡转化率,故A正确;
B.增加固体的量对化学平衡移动没有影响,则增加煤炭不可以提高H2的平衡产率,故B错误;
C.He为不参与反应的惰性气体,在恒容密闭容器中充入He对反应速率无影响,故C错误;
D.加入催化剂加快反应速率,则选择合适催化剂可以提高H2在单位时间内的产量,故D正确;
故答案为:AD;
(5)煤层地下水含量过高会降低反应区温度,温度降低,反应i化学平衡逆向移动,反应ii化学平衡正向移动,则CO2含量会减小,CO含量会增大,则曲线b是CO2;由图可知,煤层地下水含量大于0.3%时,H2占有量随煤层地下水含量增大逐渐减小,原因是随煤层地下水含量增大,温度逐渐降低,此时降低温度对反应ii化学平衡移动影响大于反应i,则H2占有量随煤层地下水含量增大逐渐减小,
故答案为:CO2;减小;随煤层地下水含量增大,温度逐渐降低,此时降低温度对反应i化学平衡移动影响大于反应ii。
故答案为:$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$;
(2)反应ⅰ+反应ⅱ得:C(s)+2H2O(g)⇌2H2(g)+CO2(g),则ΔH=+131.5kJ•mol-1+(-41.0kJ•mol-1)=+90.5kJ•mol-1;根据盖斯定律可知,反应方程式相加,反应平衡常数相乘,则反应C(s)+2H2O(g)⇌2H2(g)+CO2(g) K=K1•K2,
故答案为:+90.5;K1•K2;
(3)根据题意,结合元素守恒可知应该补充H2,
故答案为:H2;
(4)A.减小压强,平衡向气体减少的方向移动,适当减小压强能使反应i正向移动,反应ii不移动,能提高水蒸气的平衡转化率,故A正确;
B.增加固体的量对化学平衡移动没有影响,则增加煤炭不可以提高H2的平衡产率,故B错误;
C.He为不参与反应的惰性气体,在恒容密闭容器中充入He对反应速率无影响,故C错误;
D.加入催化剂加快反应速率,则选择合适催化剂可以提高H2在单位时间内的产量,故D正确;
故答案为:AD;
(5)煤层地下水含量过高会降低反应区温度,温度降低,反应i化学平衡逆向移动,反应ii化学平衡正向移动,则CO2含量会减小,CO含量会增大,则曲线b是CO2;由图可知,煤层地下水含量大于0.3%时,H2占有量随煤层地下水含量增大逐渐减小,原因是随煤层地下水含量增大,温度逐渐降低,此时降低温度对反应ii化学平衡移动影响大于反应i,则H2占有量随煤层地下水含量增大逐渐减小,
故答案为:CO2;减小;随煤层地下水含量增大,温度逐渐降低,此时降低温度对反应i化学平衡移动影响大于反应ii。