1.(2019·淮北一中期中)下列有关化学反应速率的说法中正确的是( )A.二氧化锰能加快所有的化学反应的速率B.用铁片和稀硫酸反应制取氢气时,适当增大硫酸浓度可以加快产生氢气的速率C.100mL 2 mol·L-1的盐酸与锌反应时,加入浓氯化钠溶液,生成氢气的反应速率变大D.对于任何反应,增大压强都可加快反应速率2.(2019·湖北襄阳校级期中考试)在一密闭容器中充入1mol H2和1mol I2,压强为p(Pa),并在一定温度下使其发生反应H2(g)+I2(g)2HI(g)。下列说法正确的是( )A.保持容器容积不变,向其中加入1mol H2,化学反应速率不变B.保持容器容积不变,向其中加入1mol Ar,化学反应速率增大C.保持容器内压强不变,向其中加入1mol Ar,化学反应速率不变D.保持容器内压强不变,向其中加入1mol H2(g),化学反应速率将发生变化3.(2019·宿迁市期中)向四个体积相同的密闭容器(甲、乙、丙、丁)中分别充入一定量的SO2和O2,开始反应时,按反应速率由大到小排列顺序正确的是( )甲:在500℃时,10mol SO2和5mol O2反应乙:在500℃时,用V2O5作催化剂,10mol SO2和5mol O2反应丙:在450℃时,8mol SO2和5mol O2反应丁:在500℃时,8mol SO2和5mol O2反应A.甲、乙、丙、丁 B.乙、甲、丙、丁C.乙、甲、丁、丙 D.丁、丙、乙、甲4.(2019·浏阳联考)氨基甲酸铵分解反应为NH2COONH4(s)2NH3(g)+CO2(g),在一体积恒定的密闭容器中,发生上面的反应,可以判断该反应已经达到平衡的是( )A.密闭容器中氨气的体积分数不变B.1mol NH2COONH4分解同时有17g NH3消耗C.密闭容器中混合气体的密度不变D.v(NH3)=2v(CO2)5.在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s)C(g)+D(g),下列描述中能表现反应已达到平衡状态的个数为( )①容器内温度不变 ②混合气体的密度不变 ③混合气体的压强不变 ④混合气体的平均相对分子质量不变 ⑤C(g)的物质的量浓度不变 ⑥容器内A、C、D三种气体的浓度之比为2∶1∶1 ⑦某时刻v(A)=2v(C)且不等于零 ⑧单位时间内生成nmol D,同时生成2nmol AA.4 B.5 C.6 D.76.(2017·南昌二中高一下月考)一定温度下,在某容器中进行如下可逆反应,当混合气体的平均摩尔质量不再改变时,能说明反应达到平衡状态的是( )①恒容时发生反应:A(g)+B(g)3C(g)②恒压时发生反应:A(g)+B(g)2C(g)③恒容时发生反应:A(g)+2B(g)2C(g)+D(g)④恒压时发生反应:A(g)+2B(g)3C(g)+D(s)A.②③ B.①④C.①③ D.②④7.某温度下,反应2N2O5(g)4NO2(g)+O2(g)开始时,c(N2O5)=0.0408 mol·L-1,经1min后,c(N2O5)=0.0300 mol·L-1。则该反应的反应速率为( )A.v(N2O5)=4×10-3mol·L-1·min-1B.v(N2O5)=1.08×10-2mol·L-1·min-1C.v(NO2)=1.08×10-2mol·L-1·min-1D.v(O2)=1.08×10-2mol·L-1·min-18.(2019·枣庄市薛城区期中)把0.6mol X气体和0.6mol Y气体混合于2L的密闭容器中,使它们发生如下反应3X(g)+Y(g)nZ(g)+2W(g)。5min末生成0.2mol W。若测知以Z的浓度变化表示平均反应速率为0.01mol·L-1·min-1,则化学方程式中n的值为( )A.1 B.2 C.3 D.49.(2019·浏阳联考)在4L密闭容器中充入6mol A气体和5mol B气体,在一定条件下发生反应:3A(g)+B(g)2C(g)+xD(g),5s达到平衡。达到平衡时,生成了2mol C,经测定D的浓度为0.5mol·L-1,下列判断正确的是( )A.x=1B.B的转化率为20%C.平衡时A的浓度为1.50mol·L-1D.B的平均反应速率为0.2mol·L-1·s-110.(2019·南昌二中月考)一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是( )↑物质的量 ln mol-|||-↑物质的量 ln mol-|||-1.58 Z-|||-1.20-|||-1.00-|||-0.41-|||-0.21 X-|||-0 10 时间/sA.反应开始到10s,用Z表示的反应速率为0.158mol·L-1·s-1B.10s后,该反应停止进行C.反应的化学方程式为2X(g)+Y(g)2Z(g)D.0~10s的时间内的平均反应速率:v(X)=v(Y)=0.0395 mol·L-1·s-111.下列关于反应速率与化学反应限度的说法正确的是( )A.对于任意化学反应,其他条件不变时,增大压强都一定能加快化学反应速率B.化学平衡状态不一定是该反应在给定条件下的最大限度C.可逆反应达到化学平衡状态时,正、逆反应的速率相等且都为0D.反应速率用于衡量化学反应进行的快慢,决定反应速率的主要因素是反应物的性质12.对可逆反应4NH3(g)+5O2(g)4NO(g)+6H2O(g),下列叙述中正确的是( )A.达到化学平衡时,5v正(O2)=4v逆(NO)B.若单位时间内生成xmol NO的同时,消耗xmol NH3,则反应达到平衡状态C.未达到化学平衡时,正反应速率一定不等于逆反应速率D.达到化学平衡时,3v正(NH3)=2v正(H2O)不成立
A.二氧化锰能加快所有的化学反应的速率
B.用铁片和稀硫酸反应制取氢气时,适当增大硫酸浓度可以加快产生氢气的速率
C.100mL 2 mol·L-1的盐酸与锌反应时,加入浓氯化钠溶液,生成氢气的反应速率变大
D.对于任何反应,增大压强都可加快反应速率
2.(2019·湖北襄阳校级期中考试)在一密闭容器中充入1mol H2和1mol I2,压强为p(Pa),并在一定温度下使其发生反应H2(g)+I2(g)2HI(g)。下列说法正确的是( )
A.保持容器容积不变,向其中加入1mol H2,化学反应速率不变
B.保持容器容积不变,向其中加入1mol Ar,化学反应速率增大
C.保持容器内压强不变,向其中加入1mol Ar,化学反应速率不变
D.保持容器内压强不变,向其中加入1mol H2(g),化学反应速率将发生变化
3.(2019·宿迁市期中)向四个体积相同的密闭容器(甲、乙、丙、丁)中分别充入一定量的SO2和O2,开始反应时,按反应速率由大到小排列顺序正确的是( )
甲:在500℃时,10mol SO2和5mol O2反应
乙:在500℃时,用V2O5作催化剂,10mol SO2和5mol O2反应
丙:在450℃时,8mol SO2和5mol O2反应
丁:在500℃时,8mol SO2和5mol O2反应
A.甲、乙、丙、丁 B.乙、甲、丙、丁
C.乙、甲、丁、丙 D.丁、丙、乙、甲
4.(2019·浏阳联考)氨基甲酸铵分解反应为NH2COONH4(s)2NH3(g)+CO2(g),在一体积恒定的密闭容器中,发生上面的反应,可以判断该反应已经达到平衡的是( )
A.密闭容器中氨气的体积分数不变
B.1mol NH2COONH4分解同时有17g NH3消耗
C.密闭容器中混合气体的密度不变
D.v(NH3)=2v(CO2)
5.在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s)C(g)+D(g),下列描述中能表现反应已达到平衡状态的个数为( )
①容器内温度不变 ②混合气体的密度不变 ③混合气体的压强不变 ④混合气体的平均相对分子质量不变 ⑤C(g)的物质的量浓度不变 ⑥容器内A、C、D三种气体的浓度之比为2∶1∶1 ⑦某时刻v(A)=2v(C)且不等于零 ⑧单位时间内生成nmol D,同时生成2nmol A
A.4 B.5 C.6 D.7
6.(2017·南昌二中高一下月考)一定温度下,在某容器中进行如下可逆反应,当混合气体的平均摩尔质量不再改变时,能说明反应达到平衡状态的是( )
①恒容时发生反应:A(g)+B(g)3C(g)
②恒压时发生反应:A(g)+B(g)2C(g)
③恒容时发生反应:A(g)+2B(g)2C(g)+D(g)
④恒压时发生反应:A(g)+2B(g)3C(g)+D(s)
A.②③ B.①④
C.①③ D.②④
7.某温度下,反应2N2O5(g)4NO2(g)+O2(g)开始时,c(N2O5)=0.0408 mol·L-1,经1min后,c(N2O5)=0.0300 mol·L-1。则该反应的反应速率为( )
A.v(N2O5)=4×10-3mol·L-1·min-1
B.v(N2O5)=1.08×10-2mol·L-1·min-1
C.v(NO2)=1.08×10-2mol·L-1·min-1
D.v(O2)=1.08×10-2mol·L-1·min-1
8.(2019·枣庄市薛城区期中)把0.6mol X气体和0.6mol Y气体混合于2L的密闭容器中,使它们发生如下反应3X(g)+Y(g)nZ(g)+2W(g)。5min末生成0.2mol W。若测知以Z的浓度变化表示平均反应速率为0.01mol·L-1·min-1,则化学方程式中n的值为( )
A.1 B.2 C.3 D.4
9.(2019·浏阳联考)在4L密闭容器中充入6mol A气体和5mol B气体,在一定条件下发生反应:3A(g)+B(g)2C(g)+xD(g),5s达到平衡。达到平衡时,生成了2mol C,经测定D的浓度为0.5mol·L-1,下列判断正确的是( )
A.x=1
B.B的转化率为20%
C.平衡时A的浓度为1.50mol·L-1
D.B的平均反应速率为0.2mol·L-1·s-1
10.(2019·南昌二中月考)一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是( )
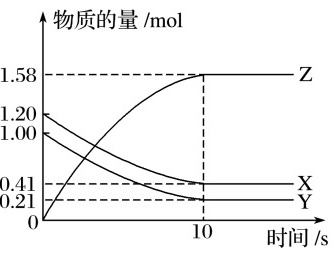
A.反应开始到10s,用Z表示的反应速率为0.158mol·L-1·s-1
B.10s后,该反应停止进行
C.反应的化学方程式为2X(g)+Y(g)2Z(g)
D.0~10s的时间内的平均反应速率:v(X)=v(Y)=0.0395 mol·L-1·s-1
11.下列关于反应速率与化学反应限度的说法正确的是( )
A.对于任意化学反应,其他条件不变时,增大压强都一定能加快化学反应速率
B.化学平衡状态不一定是该反应在给定条件下的最大限度
C.可逆反应达到化学平衡状态时,正、逆反应的速率相等且都为0
D.反应速率用于衡量化学反应进行的快慢,决定反应速率的主要因素是反应物的性质
12.对可逆反应4NH3(g)+5O2(g)4NO(g)+6H2O(g),下列叙述中正确的是( )
A.达到化学平衡时,5v正(O2)=4v逆(NO)
B.若单位时间内生成xmol NO的同时,消耗xmol NH3,则反应达到平衡状态
C.未达到化学平衡时,正反应速率一定不等于逆反应速率
D.达到化学平衡时,3v正(NH3)=2v正(H2O)不成立
题目解答
答案
解析
解析 ⑥达到平衡时A、C、D的浓度保持不变,但不一定等于2∶1∶1,A、C、D三种气体的浓度之比为2∶1∶1时,反应不一定达到平衡状态;⑦某时刻v(A)=2v(C)且不等于零,没有指明是正反应速率还是逆反应速率,不能说明反应达到平衡状态;能说明反应达到平衡状态的有①②③④⑤⑧,共6个,答案选C。
6.(2017·南昌二中高一下月考)一定温度下,在某容器中进行如下可逆反应,当混合气体的平均摩尔质量不再改变时,能说明反应达到平衡状态的是( )
①恒容时发生反应:A(g)+B(g)3C(g)
②恒压时发生反应:A(g)+B(g)2C(g)
③恒容时发生反应:A(g)+2B(g)2C(g)+D(g)
④恒压时发生反应:A(g)+2B(g)3C(g)+D(s)
A.②③ B.①④
C.①③ D.②④
考点 化学平衡状态的建立与判断
题点 化学平衡状态的判断
答案
解析 恒容时发生反应:A(g)+B(g)3C(g),气体的总质量始终不变,反应前后气体总物质的量发生变化,当气体的平均摩尔质量不再改变时,能说明反应达到平衡状态,①正确;恒压时发生反应:A(g)+B(g)2C(g),混合气体的总质量和总物质的量均不变,平均摩尔质量不再改变不能说明反应达到平衡状态,②错误;恒容时发生反应:A(g)+2B(g)2C(g)+D(g),混合气体的总质量和总物质的量始终不变,平均摩尔质量始终不变,不能说明反应达到平衡状态,③错误;恒压时发生反应:A(g)+2B(g)3C(g)+D(s),反应前后混合气体的总质量发生变化,混合气体的总物质的量一定,气体的平均摩尔质量不再改变时,能说明反应达到平衡状态,④正确,故B项正确。
题组三 化学反应速率和化学平衡的计算与图像
7.某温度下,反应2N2O5(g)4NO2(g)+O2(g)开始时,c(N2O5)=0.0408 mol·L-1,经1min后,c(N2O5)=0.0300 mol·L-1。则该反应的反应速率为( )
A.v(N2O5)=5.4×10-3mol·L-1·min-1
B.v(N2O5)=1.08×10-2mol·L-1·min-1
C.v(NO2)=1.08×10-2mol·L-1·min-1
D.v(O2)=1.08×10-2mol·L-1·min-1
答案
解析 Δc(N2O5)=0.0408 mol·L-1-0.0300 mol·L-1=0.0108 mol·L-1。根据反应中各物质的化学计量数之比,可求得Δc(NO2)=0.0216 mol·L-1,Δc(O2)=0.0054 mol·L-1。根据化学反应速率的表达式可求得v(N2O5)==1.08×10-2mol·L-1·min-1,v(NO2)==2.16×10-2mol·L-1·min-1,v(O2)==5.4×10-3mol·L-1·min-1。
8.(2019·枣庄市薛城区期中)把0.6mol X气体和0.6mol Y气体混合于2L的密闭容器中,使它们发生如下反应3X(g)+Y(g)nZ(g)+2W(g)。5min末生成0.2mol W。若测知以Z的浓度变化表示平均反应速率为0.01mol·L-1·min-1,则化学方程式中n的值为( )
A.1 B.2 C.3 D.4
考点 化学反应速率和化学平衡的计算与图像
题点 化学反应速率的计算
答案
解析 5min内W的平均化学反应速率v(W)==0.02mol·L-1·min-1,利用各物质的反应速率之比等于其化学计量数之比,Z浓度变化表示的平均反应速率为0.01mol·L-1·min-1,则v(Z)∶v(W)=0.01mol·L-1·min-1∶0.02mol·L-1·min-1=n∶2,所以n=1,选项A正确。
9.(2019·浏阳联考)在4L密闭容器中充入6mol A气体和5mol B气体,在一定条件下发生反应:3A(g)+B(g)2C(g)+xD(g),5s达到平衡。达到平衡时,生成了2mol C,经测定D的浓度为0.5mol·L-1,下列判断正确的是( )
A.x=1
B.B的转化率为20%
C.平衡时A的浓度为1.50mol·L-1
D.B的平均反应速率为0.2mol·L-1·s-1
考点 化学反应速率和化学平衡的计算与图像
题点 利用“三段式”突破化学平衡的计算
答案
解析 在4L密闭容器中充入6mol A气体和5mol B气体,在一定条件下发生反应:3A(g)+B(g)2C(g)+xD(g),达到平衡时,生成2mol C,经测定D的浓度为0.5mol·L-1,即生成D为2mol,故x=2,A项错误;反应消耗的B为1mol,故B的转化率为×100%=20%,B项正确;平衡时A的物质的量为3mol,故A的浓度为0.75mol·L-1,C项错误;消耗B的浓度是1mol÷4 L=0.25mol·L-1,则B的平均反应速率为0.25mol·L-1÷5s=0.05mol·L-1·s-1,D项错误。
10.(2019·南昌二中月考)一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是( )

A.反应开始到10s,用Z表示的反应速率为0.158mol·L-1·s-1
B.10s后,该反应停止进行
C.反应的化学方程式为2X(g)+Y(g)2Z(g)
D.0~10s的时间内的平均反应速率:v(X)=v(Y)=0.0395 mol·L-1·s-1
考点 化学反应速率和化学平衡的计算与图像
题点 化学反应速率和化学平衡图像分析
答案
解析 10s内,用Z表示的反应速率为v(Z)==0.079mol·L-1·s-1,A项错误;由图可知,10s后,该反应达到平衡状态,化学平衡状态是动态平衡,v正=v逆≠0,B项错误;由图像可以看出,随反应进行X、Y的物质的量减小,Z的物质的量增大,所以X、Y是反应物,Z是生成物,10s后X、Y、Z的物质的量为定值,不为0,反应是可逆反应,且Δn(X)∶Δn(Y)∶Δn(Z)=(1.20-0.41)mol∶(1.00-0.21)mol∶1.58mol=1∶1∶2,参加反应的物质的物质的量之比等于化学计量数之比,故反应化学方程式为X(g)+Y(g)2Z(g),C项错误;0~10s的时间内的平均反应速率:v(X)=v(Y)==0.0395 mol·L-1·s-1,D项正确。
题组四 化学反应速率与限度的综合
11.下列关于反应速率与化学反应限度的说法正确的是( )
A.对于任意化学反应,其他条件不变时,增大压强都一定能加快化学反应速率
B.化学平衡状态不一定是该反应在给定条件下的最大限度
C.可逆反应达到化学平衡状态时,正、逆反应的速率相等且都为0
D.反应速率用于衡量化学反应进行的快慢,决定反应速率的主要因素是反应物的性质
考点 化学反应速率和限度的综合
题点 相关概念的综合
答案
解析 对于任意化学反应,其他条件不变时,增大压强不一定都能加快化学反应速率,压强只适用于有气体参加的反应,A项错误;化学平衡状态是该反应在给定条件下的最大限度,B项错误;可逆反应达到化学平衡状态时,正、逆反应的速率相等但不为0,C项错误;反应速率用于衡量化学反应进行的快慢,决定反应速率的主要因素是反应物的性质,D项正确。
12.对可逆反应4NH3(g)+5O2(g)4NO(g)+6H2O(g),下列叙述中正确的是( )
A.达到化学平衡时,5v正(O2)=4v逆(NO)
B.若单位时间内生成xmol NO的同时,消耗xmol NH3,则反应达到平衡状态
C.未达到化学平衡时,正反应速率一定不等于逆反应速率
D.达到化学平衡时,3v正(NH3)=2v正(H2O)不成立
考点 化学反应速率与限度的综合
题点 相关概念和规律的综合
答案