题目
BaTiO3是一种压电材料。以BaSO4为原料,采用下列路线可制备粉状BaTiO3。TiCl-|||-水 酸 水 (NH4)2C2O4-|||-3aSO4 焙烧 → 浸取 酸化 → 浓缩结晶 溶解 沉淀 热分解 BaTiO3-|||-过量碳粉-|||-过量氯化钙-|||-CO 滤渣 母液 滤液回答下列问题:(1)“焙烧”步骤中碳粉的主要作用是 ____ 。(2)“焙烧”后固体产物有BaCl2、易溶于水的BaS和微溶于水的CaS。“浸取”时主要反应的离子方程式为 ____ 。(3)“酸化”步骤应选用的酸是 ____ (填标号)。a.稀硫酸b.浓硫酸c.盐酸d.磷酸(4)如果焙烧后的产物直接用酸浸取,是否可行?其原因是 ____ 。(5)“沉淀”步骤中生成BaTiO(C2O4)2的化学方程式为 ____ 。(6)“热分解”生成粉状钛酸钡,产生的(n_{C{O_2)}}:nCO= ____ 。
BaTiO3是一种压电材料。以BaSO4为原料,采用下列路线可制备粉状BaTiO3。
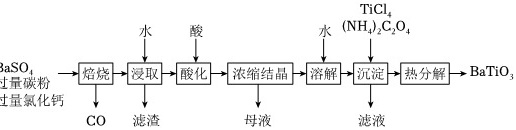
回答下列问题:
(1)“焙烧”步骤中碳粉的主要作用是 ____ 。
(2)“焙烧”后固体产物有BaCl2、易溶于水的BaS和微溶于水的CaS。“浸取”时主要反应的离子方程式为 ____ 。
(3)“酸化”步骤应选用的酸是 ____ (填标号)。
a.稀硫酸
b.浓硫酸
c.盐酸
d.磷酸
(4)如果焙烧后的产物直接用酸浸取,是否可行?其原因是 ____ 。
(5)“沉淀”步骤中生成BaTiO(C2O4)2的化学方程式为 ____ 。
(6)“热分解”生成粉状钛酸钡,产生的${n_{C{O_2}}}$:nCO= ____ 。

回答下列问题:
(1)“焙烧”步骤中碳粉的主要作用是 ____ 。
(2)“焙烧”后固体产物有BaCl2、易溶于水的BaS和微溶于水的CaS。“浸取”时主要反应的离子方程式为 ____ 。
(3)“酸化”步骤应选用的酸是 ____ (填标号)。
a.稀硫酸
b.浓硫酸
c.盐酸
d.磷酸
(4)如果焙烧后的产物直接用酸浸取,是否可行?其原因是 ____ 。
(5)“沉淀”步骤中生成BaTiO(C2O4)2的化学方程式为 ____ 。
(6)“热分解”生成粉状钛酸钡,产生的${n_{C{O_2}}}$:nCO= ____ 。
题目解答
答案
解:(1)由流程可知,“焙烧”步骤中碳粉转化为了CO,化合价升高,做还原剂,将硫酸钡转化为硫化钡,故“焙烧”步骤中碳粉的主要作用是将BaSO4还原为BaS,
故答案为:将BaSO4还原为BaS;
(2)“浸取”时多余的钙离子与硫离子生成硫化钙沉淀,故离子反应为:Ca2++S2-═CaS↓,
故答案为:Ca2++S2-═CaS↓;
(3)酸化的作用是为了将BaS转化为BaCl2而不能引入新杂质,故选用HCl,
故答案为:C;
(4)焙烧后的产物有BaS和CaS,如果直接加盐酸,多余的Ca2+无法除去,同时会放出更多的H2S污染环境,
故答案为:不可行,多余的Ca2+无法除去,同时会放出更多的H2S污染环境;
(5)由沉淀步骤可知加入了TiCl4和(NH4)2C2O4生成了BaTiO(C2O4)2,根据反应原子守恒可写出化学方程式为:BaCl2+TiCl4+2(NH4)2C2O4+H2O=BaTiO(C2O4)2+4NH4Cl+2HCl,
故答案为:BaCl2+TiCl4+2(NH4)2C2O4+H2O=BaTiO(C2O4)2+4NH4Cl+2HCl;
(6)BaTiO(C2O4)2分解方程式为:BaTiO(C2O4)2•4H2O$\frac{\underline{\;\;△\;\;}}{\;}$BaTiO3+2CO↑+2CO2↑+4H2O,则${n_{C{O_2}}}$:nCO=1:1,
故答案为:1:1。
故答案为:将BaSO4还原为BaS;
(2)“浸取”时多余的钙离子与硫离子生成硫化钙沉淀,故离子反应为:Ca2++S2-═CaS↓,
故答案为:Ca2++S2-═CaS↓;
(3)酸化的作用是为了将BaS转化为BaCl2而不能引入新杂质,故选用HCl,
故答案为:C;
(4)焙烧后的产物有BaS和CaS,如果直接加盐酸,多余的Ca2+无法除去,同时会放出更多的H2S污染环境,
故答案为:不可行,多余的Ca2+无法除去,同时会放出更多的H2S污染环境;
(5)由沉淀步骤可知加入了TiCl4和(NH4)2C2O4生成了BaTiO(C2O4)2,根据反应原子守恒可写出化学方程式为:BaCl2+TiCl4+2(NH4)2C2O4+H2O=BaTiO(C2O4)2+4NH4Cl+2HCl,
故答案为:BaCl2+TiCl4+2(NH4)2C2O4+H2O=BaTiO(C2O4)2+4NH4Cl+2HCl;
(6)BaTiO(C2O4)2分解方程式为:BaTiO(C2O4)2•4H2O$\frac{\underline{\;\;△\;\;}}{\;}$BaTiO3+2CO↑+2CO2↑+4H2O,则${n_{C{O_2}}}$:nCO=1:1,
故答案为:1:1。
解析
- 考查要点:本题围绕BaTiO3的制备工艺,考查氧化还原反应、离子反应方程式书写、物质分离与提纯、化学方程式配平及化学计量比计算等核心知识。
- 解题思路:
- (1) 根据流程中碳粉转化为CO,判断其作用为还原剂。
- (2) 抓住“浸取”步骤中钙离子与硫离子生成微溶物的特征。
- (3) 通过后续工艺需求(避免引入杂质)选择酸的类型。
- (4) 结合直接酸浸会导致杂质无法去除且产生有害气体分析。
- (5) 根据反应物与生成物的组成守恒配平化学方程式。
- (6) 通过热分解反应的化学计量关系直接得出气体体积比。
(1)碳粉的主要作用
关键点:碳粉在焙烧过程中被氧化为CO,同时将BaSO4还原为BaS。
结论:碳粉作为还原剂,实现硫酸钡到硫化钡的转化。
(2)浸取的离子方程式
关键点:浸取时,溶液中的Ca²+与S²−反应生成微溶的CaS沉淀。
方程式:
$\text{Ca}^{2+} + \text{S}^{2-} \rightarrow \text{CaS} \downarrow$
(3)酸化选用的酸
关键点:酸化需将BaS转化为BaCl2,且不能引入新杂质(如SO4²−)。
排除法:
- 稀硫酸会引入SO4²−,与后续流程矛盾。
- 盐酸可与BaS反应生成BaCl2,且HCl易挥发,不影响后续步骤。
答案:盐酸(选项c)。
(4)直接酸浸的可行性
关键点:
- 焙烧产物中含CaS,直接加酸会释放H2S气体污染环境。
- Ca²+无法通过后续步骤去除,影响产品纯度。
结论:不可行。
(5)沉淀步骤的化学方程式
配平逻辑:
- 反应物:BaCl2、TiCl4、(NH4)2C2O4、H2O。
- 生成物:BaTiO(C2O4)2、NH4Cl、HCl。
配平结果:
$\text{BaCl}_2 + \text{TiCl}_4 + 2(\text{NH}_4)_2\text{C}_2\text{O}_4 + \text{H}_2\text{O} \rightarrow \text{BaTiO}(\text{C}_2\text{O}_4)_2 + 4\text{NH}_4\text{Cl} + 2\text{HCl}$
(6)热分解的气体体积比
分解方程式:
$\text{BaTiO}(\text{C}_2\text{O}_4)_2 \cdot 4\text{H}_2\text{O} \xrightarrow{\Delta} \text{BaTiO}_3 + 2\text{CO} \uparrow + 2\text{CO}_2 \uparrow + 4\text{H}_2\text{O}$
计量比:CO2与CO的物质的量比为1:1。