题目
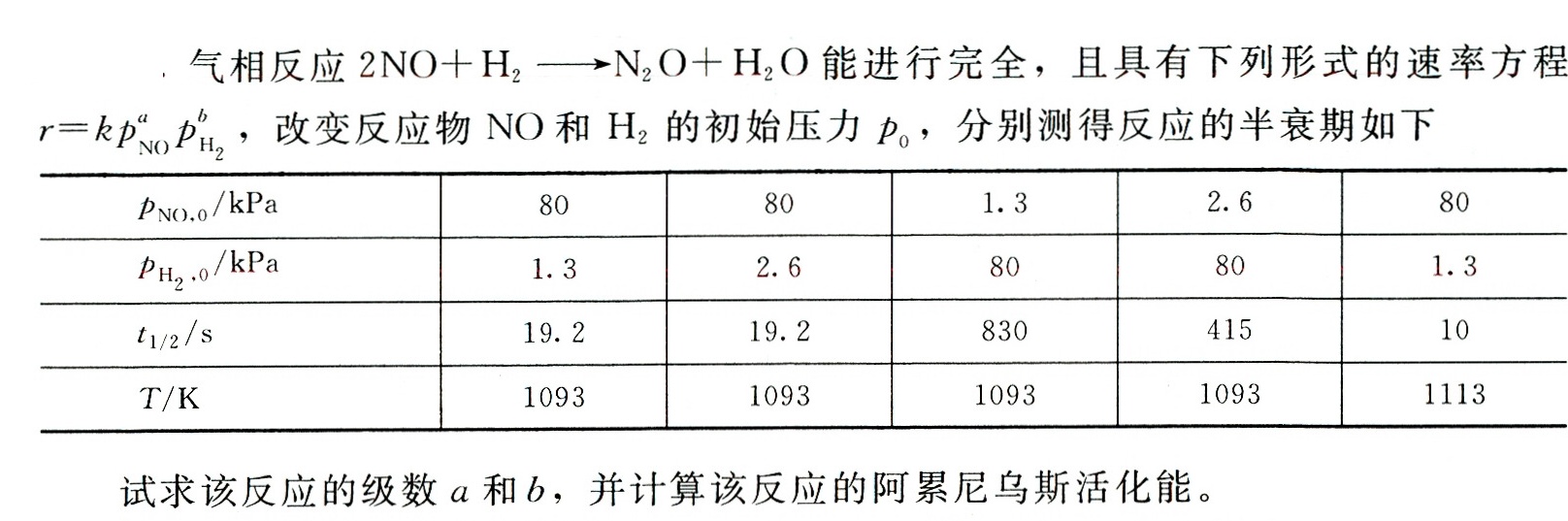
气相反应 +(H)_(2)arrow (N)_(2)O+(H)_(2)O 能进行完全,且具有下列形式的速率方程-|||-=k(P)_(N)P(P)_({H)_(2)}, 改变反应物NO和H 2的初始压力p0,分别测得反应的半衰期如下-|||-_(NO),0 K RPa 80 80 1.3 2.6 80-|||-_({H)_(2)}cdot O/kPa 1.3 2.6 80 80 1.3-|||-_(1/2/s) 19.2 19.2 830 415 10-|||-/k 1093 1093 1093 1093 1113-|||-试求该反应的级数a和b,并计算该反应的阿累尼乌斯活化能。
题目解答
答案
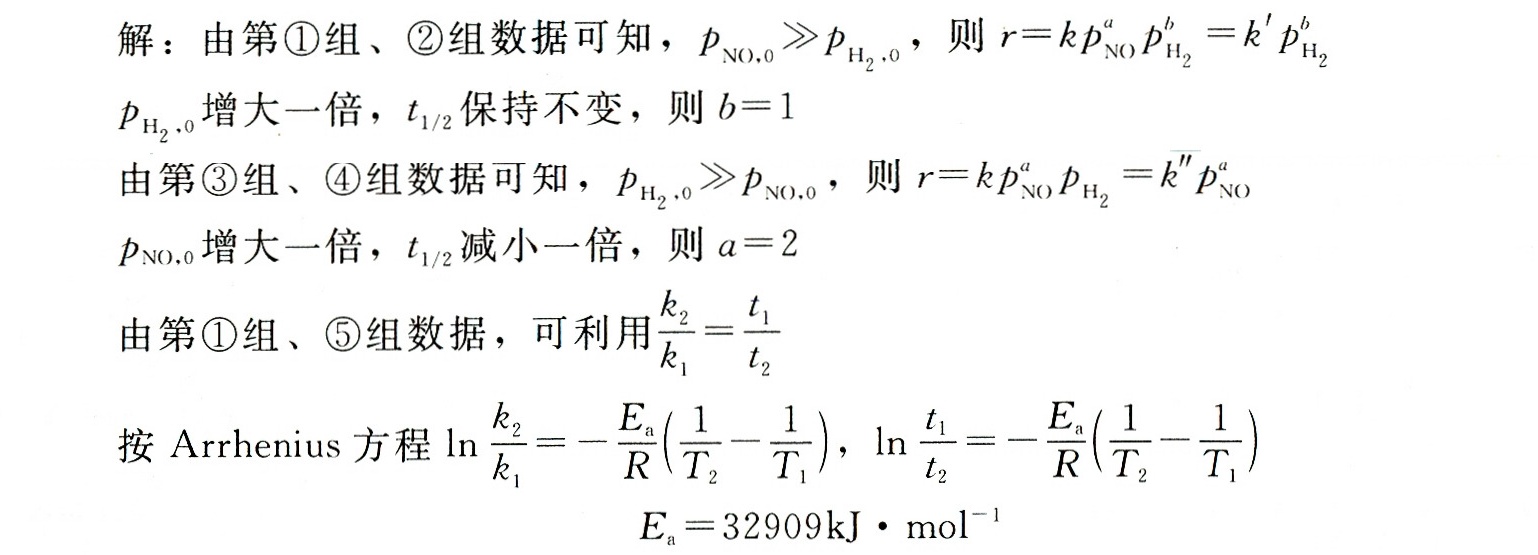
解析
步骤 1:确定反应级数
根据题目中给出的半衰期数据,我们首先需要确定反应的级数a和b。当反应物NO的初始压力远大于H2的初始压力时,反应速率主要取决于H2的浓度,即 $r=k{P}_{NO}^{a}{P}_{{H}_{2}}^{b} \approx k'{P}_{{H}_{2}}^{b}$。同理,当H2的初始压力远大于NO的初始压力时,反应速率主要取决于NO的浓度,即 $r=k{P}_{NO}^{a}{P}_{{H}_{2}}^{b} \approx k''{P}_{NO}^{a}$。通过比较不同初始压力下的半衰期,我们可以确定反应的级数。
步骤 2:确定b的值
从第①组和第②组数据可以看出,当NO的初始压力保持不变,而H2的初始压力从1.3 kPa增加到2.6 kPa时,半衰期保持不变。这表明反应对H2的浓度是一级反应,即b=1。
步骤 3:确定a的值
从第③组和第④组数据可以看出,当H2的初始压力保持不变,而NO的初始压力从1.3 kPa增加到2.6 kPa时,半衰期从830 s减少到415 s,即减少了一半。这表明反应对NO的浓度是二级反应,即a=2。
步骤 4:计算阿累尼乌斯活化能
利用第①组和第⑤组数据,我们可以计算阿累尼乌斯活化能。根据阿累尼乌斯方程,$\ln \dfrac {{k}_{2}}{{k}_{1}}=-\dfrac {{E}_{a}}{R}(\dfrac {1}{{T}_{2}}-\dfrac {1}{{T}_{1}})$,其中k是反应速率常数,T是温度,R是气体常数。由于半衰期与速率常数成反比,即$\dfrac {{k}_{2}}{{k}_{1}}=\dfrac {{t}_{1}}{{t}_{2}}$,我们可以将阿累尼乌斯方程改写为$\ln \dfrac {{t}_{1}}{{t}_{2}}=-\dfrac {{E}_{a}}{R}(\dfrac {1}{{T}_{2}}-\dfrac {1}{{T}_{1}})$。将第①组和第⑤组数据代入,可以计算出阿累尼乌斯活化能。
根据题目中给出的半衰期数据,我们首先需要确定反应的级数a和b。当反应物NO的初始压力远大于H2的初始压力时,反应速率主要取决于H2的浓度,即 $r=k{P}_{NO}^{a}{P}_{{H}_{2}}^{b} \approx k'{P}_{{H}_{2}}^{b}$。同理,当H2的初始压力远大于NO的初始压力时,反应速率主要取决于NO的浓度,即 $r=k{P}_{NO}^{a}{P}_{{H}_{2}}^{b} \approx k''{P}_{NO}^{a}$。通过比较不同初始压力下的半衰期,我们可以确定反应的级数。
步骤 2:确定b的值
从第①组和第②组数据可以看出,当NO的初始压力保持不变,而H2的初始压力从1.3 kPa增加到2.6 kPa时,半衰期保持不变。这表明反应对H2的浓度是一级反应,即b=1。
步骤 3:确定a的值
从第③组和第④组数据可以看出,当H2的初始压力保持不变,而NO的初始压力从1.3 kPa增加到2.6 kPa时,半衰期从830 s减少到415 s,即减少了一半。这表明反应对NO的浓度是二级反应,即a=2。
步骤 4:计算阿累尼乌斯活化能
利用第①组和第⑤组数据,我们可以计算阿累尼乌斯活化能。根据阿累尼乌斯方程,$\ln \dfrac {{k}_{2}}{{k}_{1}}=-\dfrac {{E}_{a}}{R}(\dfrac {1}{{T}_{2}}-\dfrac {1}{{T}_{1}})$,其中k是反应速率常数,T是温度,R是气体常数。由于半衰期与速率常数成反比,即$\dfrac {{k}_{2}}{{k}_{1}}=\dfrac {{t}_{1}}{{t}_{2}}$,我们可以将阿累尼乌斯方程改写为$\ln \dfrac {{t}_{1}}{{t}_{2}}=-\dfrac {{E}_{a}}{R}(\dfrac {1}{{T}_{2}}-\dfrac {1}{{T}_{1}})$。将第①组和第⑤组数据代入,可以计算出阿累尼乌斯活化能。