3(10分) lt lt -|||-向含有 ^2+ 和 (e)^2+ 浓度均为 .020molcdot (dm)^-3 的溶液中通入H2 S达到饱和,欲使两种离子-|||-完全分离,则溶液的pH值应控制在什么范围?-|||-已知 _(sp)(CdS)=8.0times (10)^-27, _(sp)^-(FeS)=4.0times (10)^-19, 常温常压下,饱和H 2S溶液的浓度为-|||-.1molcdot (L)^-1, H2S的电离常数为 _(甲)^infty =1.3times (10)^-7 _(a)^theta =7.1times (10)^-15

题目解答
答案
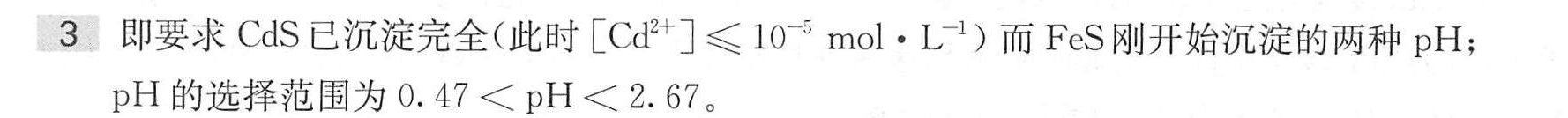
解析
考查要点:本题主要考查沉淀溶解平衡的应用,涉及溶度积($K_{sp}$)的计算、弱酸(H₂S)的分步解离平衡,以及通过控制pH实现离子分离的条件判断。
解题核心思路:
- 确定Cd²⁺完全沉淀的条件:当$[Cd^{2+}] \leq 10^{-5} \, \text{mol/L}$时,CdS沉淀完全。利用$K_{sp}^{\theta}(CdS)$计算对应的$[S^{2-}]$,结合H₂S的解离平衡求出此时的pH下限。
- 确定Fe²⁺开始沉淀的条件:当$[Fe^{2+}] \cdot [S^{2-}] = K_{sp}^{\theta}(FeS)$时,FeS开始沉淀。利用$K_{sp}^{\theta}(FeS)$计算对应的$[S^{2-}]$,结合H₂S的解离平衡求出此时的pH上限。
- 综合pH范围:确保Cd²⁺已沉淀完全而Fe²⁺尚未沉淀的pH区间。
破题关键点:
- H₂S的解离平衡:总解离常数$K_{\text{总}} = K_{a1} \cdot K_{a2}$,需通过$[S^{2-}]$与pH的关系建立方程。
- 溶度积与浓度关系:通过$K_{sp} = [M^{2+}][S^{2-}]$联立求解$[S^{2-}]$,再结合H₂S解离平衡求pH。
1. Cd²⁺完全沉淀的pH下限
当$[Cd^{2+}] = 10^{-5} \, \text{mol/L}$时,根据$K_{sp}^{\theta}(CdS)$:
$K_{sp}^{\theta}(CdS) = [Cd^{2+}][S^{2-}] \implies [S^{2-}] = \frac{K_{sp}^{\theta}(CdS)}{[Cd^{2+}]} = \frac{8.0 \times 10^{-27}}{10^{-5}} = 8.0 \times 10^{-22} \, \text{mol/L}.$
H₂S解离平衡中,$[S^{2-}]$由总解离常数决定:
$K_{\text{总}} = K_{a1} \cdot K_{a2} = (1.3 \times 10^{-7})(7.1 \times 10^{-15}) = 9.23 \times 10^{-22},$
$[S^{2-}] = \frac{K_{\text{总}} \cdot [H_2S]}{[H^+]^2} \implies 8.0 \times 10^{-22} = \frac{(9.23 \times 10^{-22})(0.1)}{[H^+]^2}.$
解得:
$[H^+]^2 = \frac{9.23 \times 10^{-23}}{8.0 \times 10^{-22}} \approx 0.115 \implies [H^+] \approx 0.34 \implies \text{pH} = -\log(0.34) \approx 0.47.$
2. Fe²⁺开始沉淀的pH上限
当$[Fe^{2+}] = 0.020 \, \text{mol/L}$时,根据$K_{sp}^{\theta}(FeS)$:
$K_{sp}^{\theta}(FeS) = [Fe^{2+}][S^{2-}] \implies [S^{2-}] = \frac{K_{sp}^{\theta}(FeS)}{[Fe^{2+}]} = \frac{4.0 \times 10^{-19}}{0.020} = 2.0 \times 10^{-17} \, \text{mol/L}.$
同理,结合H₂S解离平衡:
$2.0 \times 10^{-17} = \frac{(9.23 \times 10^{-22})(0.1)}{[H^+]^2}.$
解得:
$[H^+]^2 = \frac{9.23 \times 10^{-23}}{2.0 \times 10^{-17}} \approx 4.615 \times 10^{-6} \implies [H^+] \approx 0.00215 \implies \text{pH} = -\log(0.00215) \approx 2.67.$
3. 综合pH范围
- Cd²⁺完全沉淀要求pH ≥ 0.47;
- Fe²⁺不沉淀要求pH > 2.67;
- 分离条件需同时满足,故pH范围为:
$0.47 < \text{pH} < 2.67.$