题目
第三章(速度定律和化学计量方程)作业答案:P3-12A(1)将H2作为计算的基准,建立等压等温流动系统中等摩尔H2和H2进料时下列反应的完整的化学计量表。H2(2)如果入口总压为16.4atm,入口温度为1727℃,计算H2的转化率为60%时氨和氢气的浓度。(3)如果将H2作为计算的基准,H2的转化率能达到60%吗?
第三章(速度定律和化学计量方程)作业答案:
P3-12A(1)将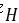 作为计算的基准,建立等压等温流动系统中等摩尔
作为计算的基准,建立等压等温流动系统中等摩尔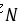 和
和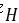 进料时下列反应的完整的化学计量表。
进料时下列反应的完整的化学计量表。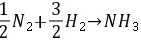
(2)如果入口总压为16.4atm,入口温度为1727℃,计算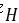 的转化率为60%时氨和氢气的浓度。
的转化率为60%时氨和氢气的浓度。
(3)如果将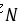 作为计算的基准,
作为计算的基准,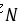 的转化率能达到60%吗?
的转化率能达到60%吗?
题目解答
答案
解:(1)以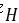 作为计算基准,化学反应式整理为:
作为计算基准,化学反应式整理为: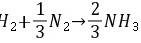
化学计量表为:
组分 | 符号 | 初始量 | 变化量 | 剩余量 |
A | ||||
B | ||||
C | ||||
T |
(2)由理想气体定律可得入口处A的浓度为:
对于反应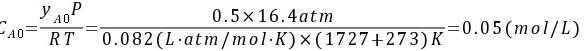 ,
,
入口处:F=F,则y=0.5,所以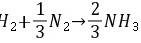
由于压力和温度保持不变,
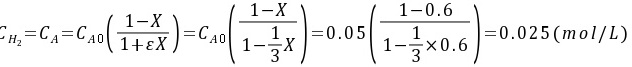
(3)以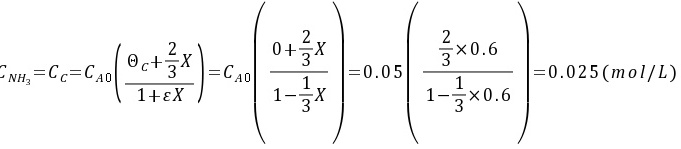 作为计算基准,化学反应式整理为:
作为计算基准,化学反应式整理为:
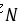 ,y=0.5,所以
,y=0.5,所以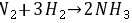
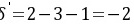
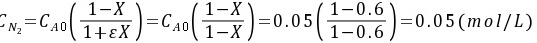
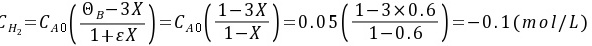 不能小于0,所以以作为计算基准,的转化率不能达到60%。
不能小于0,所以以作为计算基准,的转化率不能达到60%。
解析
步骤 1:化学计量表的建立
以H2作为计算基准,化学反应式整理为:${H}_{2}+\dfrac {1}{3}{N}_{2}\rightarrow \dfrac {2}{3}N{H}_{3}$
组分
符号
初始量
变化量
剩余量
A
B
C
T
步骤 2:计算入口处A的浓度
由理想气体定律可得入口处A的浓度为:
${S}_{\Delta }=\dfrac {\Delta P}{RT}=\dfrac {0.5\times 16.4atm}{0.082(L\cdot atm)/(mol\cdot K)\times (1727+273)K}=0.05(mol/L)$
步骤 3:计算H2的转化率为60%时氨和氢气的浓度
由于压力和温度保持不变,${H}_{2}+\dfrac {1}{3}{N}_{2}\rightarrow \dfrac {2}{3}N{H}_{3}$
${C}_{NH_{3}}=\dfrac {2}{3}\times 0.6\times 0.05(mol/L)=0.02(mol/L)$
${C}_{H_{2}}=0.05(mol/L)-0.6\times 0.05(mol/L)=0.02(mol/L)$
步骤 4:以N2作为计算基准时的转化率
以N2作为计算基准,化学反应式整理为:${N}_{2}+3{H}_{2}\rightarrow 2N{H}_{3}$
${m}_{2}={C}_{mo}(\dfrac {1-X}{1+{e}^{X}})={C}_{mo}(\dfrac {1-X}{1-X})=0.05(\dfrac {1-0.6}{1-0.6})=0.05(mol/L)$
不能小于0,所以以N2作为计算基准,H2的转化率不能达到60%。
以H2作为计算基准,化学反应式整理为:${H}_{2}+\dfrac {1}{3}{N}_{2}\rightarrow \dfrac {2}{3}N{H}_{3}$
组分
符号
初始量
变化量
剩余量
A
B
C
T
步骤 2:计算入口处A的浓度
由理想气体定律可得入口处A的浓度为:
${S}_{\Delta }=\dfrac {\Delta P}{RT}=\dfrac {0.5\times 16.4atm}{0.082(L\cdot atm)/(mol\cdot K)\times (1727+273)K}=0.05(mol/L)$
步骤 3:计算H2的转化率为60%时氨和氢气的浓度
由于压力和温度保持不变,${H}_{2}+\dfrac {1}{3}{N}_{2}\rightarrow \dfrac {2}{3}N{H}_{3}$
${C}_{NH_{3}}=\dfrac {2}{3}\times 0.6\times 0.05(mol/L)=0.02(mol/L)$
${C}_{H_{2}}=0.05(mol/L)-0.6\times 0.05(mol/L)=0.02(mol/L)$
步骤 4:以N2作为计算基准时的转化率
以N2作为计算基准,化学反应式整理为:${N}_{2}+3{H}_{2}\rightarrow 2N{H}_{3}$
${m}_{2}={C}_{mo}(\dfrac {1-X}{1+{e}^{X}})={C}_{mo}(\dfrac {1-X}{1-X})=0.05(\dfrac {1-0.6}{1-0.6})=0.05(mol/L)$
不能小于0,所以以N2作为计算基准,H2的转化率不能达到60%。