题目
9.某温度下,Br2和Cl22在CCl4溶剂中发生下述反应:-|||-(r)_(2)+(Cl)_(2)leftharpoons 2BrCl-|||-平衡建立时, ((Br)_(2))=c((Cl)_(2))=0.0043molcdot (dm)^-3 (BrCl)=0.0114molcdot (dm)^-3 试求-|||-(1)反应的标准平衡常数 Ke;-|||-(2)如果平衡建立后,再加入 .01molcdot (dm)^-3 的Br2到系统中(体积变化可忽略),计算平衡再次建立-|||-时,系统中各组分的浓度;-|||-(3)用以上结果说明浓度对化学平衡的影响。

题目解答
答案
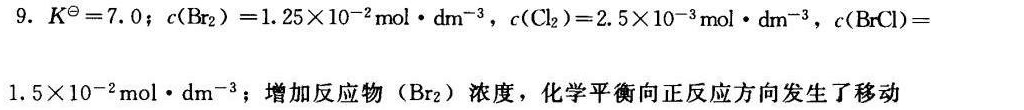
解析
步骤 1:计算标准平衡常数 $K_{\theta}$
根据化学平衡方程 ${Br}_{2}+{Cl}_{2}\rightleftharpoons 2BrCl$,标准平衡常数 $K_{\theta}$ 可以表示为:
$$K_{\theta} = \frac{[BrCl]^2}{[Br_2][Cl_2]}$$
其中,$[BrCl]$、$[Br_2]$ 和 $[Cl_2]$ 分别表示平衡时各组分的浓度。将题目中给出的浓度值代入上述公式,可以计算出 $K_{\theta}$ 的值。
步骤 2:计算加入 $0.01mol\cdot {dm}^{-3}$ 的Br2后,平衡再次建立时各组分的浓度
加入 $0.01mol\cdot {dm}^{-3}$ 的Br2后,系统中Br2的浓度变为 $0.0043mol\cdot {dm}^{-3} + 0.01mol\cdot {dm}^{-3} = 0.0143mol\cdot {dm}^{-3}$。设平衡再次建立时,Br2和Cl2的浓度分别为 $x$ 和 $y$,BrCl的浓度为 $z$。根据化学平衡方程,可以列出以下方程组:
$$x + y = 0.0143mol\cdot {dm}^{-3}$$
$$y = 0.0043mol\cdot {dm}^{-3}$$
$$z = 2(0.0143mol\cdot {dm}^{-3} - x)$$
同时,根据标准平衡常数 $K_{\theta}$ 的定义,可以列出以下方程:
$$K_{\theta} = \frac{z^2}{xy}$$
将上述方程组和标准平衡常数的方程联立,可以求解出平衡再次建立时各组分的浓度。
步骤 3:分析浓度对化学平衡的影响
根据计算结果,可以分析加入Br2后,平衡再次建立时各组分浓度的变化,从而说明浓度对化学平衡的影响。
根据化学平衡方程 ${Br}_{2}+{Cl}_{2}\rightleftharpoons 2BrCl$,标准平衡常数 $K_{\theta}$ 可以表示为:
$$K_{\theta} = \frac{[BrCl]^2}{[Br_2][Cl_2]}$$
其中,$[BrCl]$、$[Br_2]$ 和 $[Cl_2]$ 分别表示平衡时各组分的浓度。将题目中给出的浓度值代入上述公式,可以计算出 $K_{\theta}$ 的值。
步骤 2:计算加入 $0.01mol\cdot {dm}^{-3}$ 的Br2后,平衡再次建立时各组分的浓度
加入 $0.01mol\cdot {dm}^{-3}$ 的Br2后,系统中Br2的浓度变为 $0.0043mol\cdot {dm}^{-3} + 0.01mol\cdot {dm}^{-3} = 0.0143mol\cdot {dm}^{-3}$。设平衡再次建立时,Br2和Cl2的浓度分别为 $x$ 和 $y$,BrCl的浓度为 $z$。根据化学平衡方程,可以列出以下方程组:
$$x + y = 0.0143mol\cdot {dm}^{-3}$$
$$y = 0.0043mol\cdot {dm}^{-3}$$
$$z = 2(0.0143mol\cdot {dm}^{-3} - x)$$
同时,根据标准平衡常数 $K_{\theta}$ 的定义,可以列出以下方程:
$$K_{\theta} = \frac{z^2}{xy}$$
将上述方程组和标准平衡常数的方程联立,可以求解出平衡再次建立时各组分的浓度。
步骤 3:分析浓度对化学平衡的影响
根据计算结果,可以分析加入Br2后,平衡再次建立时各组分浓度的变化,从而说明浓度对化学平衡的影响。