题目
X、Y、Z、W、R、Q为原子序数依次增大的六种短周期主族元素。X是原子半径最小的元素;Y原子最外层电子数是核外电子层数的3倍;Z是短周期中金属性最强的元素;W是地壳中含量最多的金属元素;R的最高正价与最低负价代数和为4,请回答下列问题:(1)用电子式表示Z2R的形成过程 ____ 。(2)W在周期表中的位置是 ____ 。(3)ZYX的电子式为 ____ ,X2Y2的结构式为 ____ ,Z2Y2中含有的化学键类型为 ____ 。(4)Y、Z、W三种元素对应的简单离子半径由大到小的顺序是 ____ (用元素的离子符号表示)。(5)下列说法能证明非金属性Q强于R的是 ____ (填字母)。a.简单阴离子的还原性:Q>Rb.简单氢化物热稳定性:Q>Rc.氧化物对应的水化物的酸性:Q>R(6)W的单质与Z的最高价氧化物对应的水化物反应的化学方程式是 ____ 。(7)处于周期表中对角线位置(左上方和右下方)的元素,其性质具有相似性,称为“对角线规则”,写出Be(OH)2与氢氧化钠溶液反应的化学方程式 ____ 。
X、Y、Z、W、R、Q为原子序数依次增大的六种短周期主族元素。X是原子半径最小的元素;Y原子最外层电子数是核外电子层数的3倍;Z是短周期中金属性最强的元素;W是地壳中含量最多的金属元素;R的最高正价与最低负价代数和为4,请回答下列问题:
(1)用电子式表示Z2R的形成过程 ____ 。
(2)W在周期表中的位置是 ____ 。
(3)ZYX的电子式为 ____ ,X2Y2的结构式为 ____ ,Z2Y2中含有的化学键类型为 ____ 。
(4)Y、Z、W三种元素对应的简单离子半径由大到小的顺序是 ____ (用元素的离子符号表示)。
(5)下列说法能证明非金属性Q强于R的是 ____ (填字母)。
a.简单阴离子的还原性:Q>R
b.简单氢化物热稳定性:Q>R
c.氧化物对应的水化物的酸性:Q>R
(6)W的单质与Z的最高价氧化物对应的水化物反应的化学方程式是 ____ 。
(7)处于周期表中对角线位置(左上方和右下方)的元素,其性质具有相似性,称为“对角线规则”,写出Be(OH)2与氢氧化钠溶液反应的化学方程式 ____ 。
(1)用电子式表示Z2R的形成过程 ____ 。
(2)W在周期表中的位置是 ____ 。
(3)ZYX的电子式为 ____ ,X2Y2的结构式为 ____ ,Z2Y2中含有的化学键类型为 ____ 。
(4)Y、Z、W三种元素对应的简单离子半径由大到小的顺序是 ____ (用元素的离子符号表示)。
(5)下列说法能证明非金属性Q强于R的是 ____ (填字母)。
a.简单阴离子的还原性:Q>R
b.简单氢化物热稳定性:Q>R
c.氧化物对应的水化物的酸性:Q>R
(6)W的单质与Z的最高价氧化物对应的水化物反应的化学方程式是 ____ 。
(7)处于周期表中对角线位置(左上方和右下方)的元素,其性质具有相似性,称为“对角线规则”,写出Be(OH)2与氢氧化钠溶液反应的化学方程式 ____ 。
题目解答
答案
解:由上述分析可知,X为H、Y为O、Z为Na、W为Al、R为S、Q为Cl元素;
(1)用电子式表示Na2S的形成过程: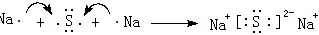 ,
,
故答案为: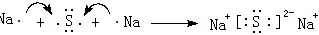 ;
;
(2)W是Al元素,在周期表中的位置是第三周期第ⅢA族,
故答案为:第三周期第ⅢA族;
(3)ZYX是NaOH,其电子式为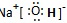 ;X2Y2是H2O2,其结构式为H-O-O-H;Z2Y2是Na2O2,含有的化学键类型为离子键、共价键,
;X2Y2是H2O2,其结构式为H-O-O-H;Z2Y2是Na2O2,含有的化学键类型为离子键、共价键,
故答案为: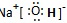 ;H-O-O-H;离子键、共价键;
;H-O-O-H;离子键、共价键;
(4)具有相同电子排布的离子,核电荷数越大离子半径小,则Y、Z、W三种元素对应的简单离子半径由大到小的顺序是O2->Na+>Al3+,
故答案为:O2->Na+>Al3+;
(5)a.元素的非金属性越强,阴离子的还原性越弱,氯元素的非金属性比硫强,简单阴离子的还原性:S2->Cl-,故a错误;
b.元素非金属性与去氢化物稳定性一致,HCl的稳定性比H2S强,说明Cl元素非金属性比S强,故b正确;
c.应比较最高价含氧酸的酸性,证明非金属性Q强于R,故c错误,
故答案为:b;
(6)W的单质是Al,Z的最高价氧化物对应的水化物是NaOH,二者反应的化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(7)Be(OH)2与Al(OH)3性质类似,类比Al(OH)3与NaOH反应可知,Be(OH)2与氢氧化钠溶液反应的化学方程式为Be(OH)2+2NaOH=Na2BeO2+2H2O,
故答案为:Be(OH)2+2NaOH=Na2BeO2+2H2O。
(1)用电子式表示Na2S的形成过程:
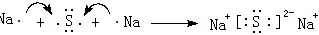 ,
,故答案为:
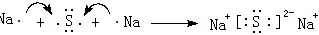 ;
;(2)W是Al元素,在周期表中的位置是第三周期第ⅢA族,
故答案为:第三周期第ⅢA族;
(3)ZYX是NaOH,其电子式为
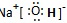 ;X2Y2是H2O2,其结构式为H-O-O-H;Z2Y2是Na2O2,含有的化学键类型为离子键、共价键,
;X2Y2是H2O2,其结构式为H-O-O-H;Z2Y2是Na2O2,含有的化学键类型为离子键、共价键,故答案为:
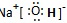 ;H-O-O-H;离子键、共价键;
;H-O-O-H;离子键、共价键;(4)具有相同电子排布的离子,核电荷数越大离子半径小,则Y、Z、W三种元素对应的简单离子半径由大到小的顺序是O2->Na+>Al3+,
故答案为:O2->Na+>Al3+;
(5)a.元素的非金属性越强,阴离子的还原性越弱,氯元素的非金属性比硫强,简单阴离子的还原性:S2->Cl-,故a错误;
b.元素非金属性与去氢化物稳定性一致,HCl的稳定性比H2S强,说明Cl元素非金属性比S强,故b正确;
c.应比较最高价含氧酸的酸性,证明非金属性Q强于R,故c错误,
故答案为:b;
(6)W的单质是Al,Z的最高价氧化物对应的水化物是NaOH,二者反应的化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(7)Be(OH)2与Al(OH)3性质类似,类比Al(OH)3与NaOH反应可知,Be(OH)2与氢氧化钠溶液反应的化学方程式为Be(OH)2+2NaOH=Na2BeO2+2H2O,
故答案为:Be(OH)2+2NaOH=Na2BeO2+2H2O。
解析
- 元素推断:根据原子序数递增和各元素特征性质(如X原子半径最小、Y最外层电子数与电子层数关系、Z的金属性最强等),确定各元素为H、O、Na、Al、S、Cl。
- 核心知识点:
- 电子式与结构式:电子式需展示原子最外层电子,结构式仅用单线表示原子间结合。
- 离子半径比较:同电子层结构下,核电荷数越大,离子半径越小。
- 非金属性判断:通过氢化物稳定性、最高价氧化物酸性等判断。
- 对角线规则:类比同主族元素性质书写反应方程式。
(1)用电子式表示Z₂R的形成过程
关键步骤:
- 原子结构分析:Na原子最外层1个电子,S原子最外层6个电子。
- 电子转移:Na失去电子形成Na⁺,S得到2个电子形成S²⁻。
- 形成离子键:Na⁺与S²⁻通过静电吸引结合成Na₂S。
(2)W在周期表中的位置
关键点:
- W为Al,原子序数13,位于第三周期第ⅢA族。
(3)ZYX的电子式、X₂Y₂的结构式及化学键类型
分步解析:
- ZYX为NaOH:Na⁺与OH⁻通过离子键结合,OH⁻内部O与H共用电子。
- X₂Y₂为H₂O₂:结构式为H-O-O-H,仅用单线表示原子间结合。
- Na₂O₂中的化学键:O₂²⁻内部共价键,Na⁺与O₂²⁻间离子键。
(4)离子半径比较
规律应用:
- O²⁻、Na⁺、Al³⁺电子层相同,核电荷数越大,半径越小,故顺序为O²⁻ > Na⁺ > Al³⁺。
(5)非金属性判断
选项分析:
- b正确:HCl稳定性强于H₂S,说明Cl非金属性强于S。
- a、c错误:阴离子还原性与非金属性相反,未比较最高价氧化物酸性。
(6)W与Z的最高价氧化物对应水化物反应
反应本质:Al与强碱反应生成偏铝酸盐和氢气,方程式需配平。
(7)Be(OH)₂与NaOH反应
类比法:Be与Al对角线性质相似,反应生成BeO₂²⁻和水。