某班同学用如下实验探究Fe2+、Fe3+和FeO42-的性质。资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。回答下列问题:(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是________;将FeCl3晶体溶于浓盐酸,再稀释到需要的浓度,盐酸的作用是________。(2)制备K2FeO4(夹持装置略)后,取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:13、下列图示与对应的叙述不相符的是 反应物-|||-n(Mn^2)-|||-6 高图1-|||-↑n(沉淀)-|||-2-|||-o 时间3 0 时间图4A、图1表示相同温度下,向pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH的变化曲线,其中a表示氨水稀释时pH的变化曲线 B、图2表示向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸所得沉淀物质的量与盐酸体积的关系 C、图3表示压强对可逆反应CO(g)+H2O(g)⇌CO2(g)+H2(g)的影响,乙的压强比甲的压强大 D、图4表示10 mL 0.01 mol•L﹣1KMnO4酸性溶液与过量的0.1 mol•L﹣1 H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用)14.下列事实不能用勒夏特列原理解释的是A.开启啤酒瓶后,瓶中立刻泛起大量泡沫B.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深C.向氯水中加CaCO3后,溶液漂白性增强D.在含有[Fe(SCN)]2+的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去15.下列叙述中正确的是A.构成原电池正极和负极的材料必须是两种金属B.由铜、锌作电极与硫酸铜溶液组成的原电池中铜是负极C.马口铁(镀锡铁)破损时与电解质溶液接触,锡先被腐蚀D.铜锌原电池工作时,若有13 g锌被溶解,电路中就有0.4 mol电子通过16、下列有关化学用语表示正确的是A、NH4Br的电子式:反应物-|||-n(Mn^2)-|||-6 高图1-|||-↑n(沉淀)-|||-2-|||-o 时间3 0 时间图4 B、S原子的结构示意图:反应物-|||-n(Mn^2)-|||-6 高图1-|||-↑n(沉淀)-|||-2-|||-o 时间3 0 时间图4 C、乙醇的结构简式:C2H6O D、原子核内有18个中子的氯原子:反应物-|||-n(Mn^2)-|||-6 高图1-|||-↑n(沉淀)-|||-2-|||-o 时间3 0 时间图4Cl17、北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质熔融状态下能导电.下列有关分析正确的是A、K3C60和C60中都含有共价键 B、钾的核外电子排布为:1s22s22p63s23p63d104s1 C、K3C60和C60都属于分子晶体,具有较低的熔点 D、C60与12C互为同素异形体18、下列说法正确的是A、可逆反应在其他条件不变时,升高温度,可以减小反应的活化能,加快反应速率 B、S电子云是球形对称的,P电子云是纺锤形,电子云中每个小黑点代表一个电子 C、氮原子的第一电离能低于氧原子的第一电离能,因为氮比氧非金属性弱 D、Fe3+比Fe2+稳定,因为Fe3+价电子构型是3d5, d亚层处于半充满状态,稳定方案Ⅰ取少量a,滴加KSCN溶液至过量,溶液呈红色。方案Ⅱ用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。反应物-|||-n(Mn^2)-|||-6 高图1-|||-↑n(沉淀)-|||-2-|||-o 时间3 0 时间图4Ⅰ.由方案Ⅰ中溶液变红可知a中含有______离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由________________产生(用方程式表示)。Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是________________。根据K2FeO4的制备原理3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O得出:氧化性Cl2______FeO42-(填“>”或“
某班同学用如下实验探究Fe2+、Fe3+和FeO42-的性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是________;将FeCl3晶体溶于浓盐酸,再稀释到需要的浓度,盐酸的作用是________。
(2)制备K2FeO4(夹持装置略)后,取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
13、下列图示与对应的叙述不相符的是 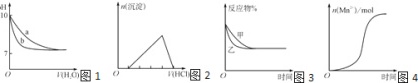
A、图1表示相同温度下,向pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH的变化曲线,其中a表示氨水稀释时pH的变化曲线 B、图2表示向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸所得沉淀物质的量与盐酸体积的关系 C、图3表示压强对可逆反应CO(g)+H2O(g)⇌CO2(g)+H2(g)的影响,乙的压强比甲的压强大 D、图4表示10 mL 0.01 mol•L﹣1KMnO4酸性溶液与过量的0.1 mol•L﹣1 H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用)
14.下列事实不能用勒夏特列原理解释的是
A.开启啤酒瓶后,瓶中立刻泛起大量泡沫
B.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
C.向氯水中加CaCO3后,溶液漂白性增强
D.在含有[Fe(SCN)]2+的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
15.下列叙述中正确的是
A.构成原电池正极和负极的材料必须是两种金属
B.由铜、锌作电极与硫酸铜溶液组成的原电池中铜是负极
C.马口铁(镀锡铁)破损时与电解质溶液接触,锡先被腐蚀
D.铜锌原电池工作时,若有13 g锌被溶解,电路中就有0.4 mol电子通过
16、下列有关化学用语表示正确的是
A、NH4Br的电子式: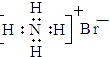 B、S原子的结构示意图:
B、S原子的结构示意图: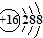 C、乙醇的结构简式:C2H6O D、原子核内有18个中子的氯原子:
C、乙醇的结构简式:C2H6O D、原子核内有18个中子的氯原子: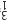 Cl
Cl
17、北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质熔融状态下能导电.下列有关分析正确的是
A、K3C60和C60中都含有共价键 B、钾的核外电子排布为:1s22s22p63s23p63d104s1 C、K3C60和C60都属于分子晶体,具有较低的熔点 D、C60与12C互为同素异形体
18、下列说法正确的是
A、可逆反应在其他条件不变时,升高温度,可以减小反应的活化能,加快反应速率 B、S电子云是球形对称的,P电子云是纺锤形,电子云中每个小黑点代表一个电子 C、氮原子的第一电离能低于氧原子的第一电离能,因为氮比氧非金属性弱 D、Fe3+比Fe2+稳定,因为Fe3+价电子构型是3d5, d亚层处于半充满状态,稳定
方案Ⅰ
取少量a,滴加KSCN溶液至过量,溶液呈红色。
方案Ⅱ
用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。
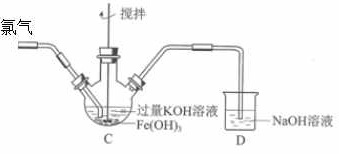
Ⅰ.由方案Ⅰ中溶液变红可知a中含有______离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由________________产生(用方程式表示)。
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是________________。根据K2FeO4的制备原理3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O得出:氧化性Cl2______FeO42-(填“>”或“
题目解答
答案
[答案] (1). 防止亚铁离子被氧化 (2). 抑制铁离子水解 (3). Fe3+ (4). 4FeO42-+20H-=4Fe3++3O2↑+10H2O (5). 排除ClO-的干扰 (6). > (7). 溶液的酸碱性不同