题目
取某一天然水样100.0 mL,加酚酞指示剂时,未滴入HCl溶液,溶液已呈现终点颜色,接着以甲基橙为指示剂,用0.05000 mol / LHCl滴定至刚好橙红色,用去13.50 mL,问该水样中有何种碱度,其含量为多少(以mg / L 表示)?
取某一天然水样100.0 mL,加酚酞指示剂时,未滴入HCl溶液,溶液已呈现终点颜色,接着以甲基橙为指示剂,用0.05000 mol / LHCl滴定至刚好橙红色,用去13.50 mL,问该水样中有何种碱度,其含量为多少(以mg / L 表示)?
题目解答
答案
解:V1= 0,V2>0 ,∴水样中只含HCO3ˉ碱度。
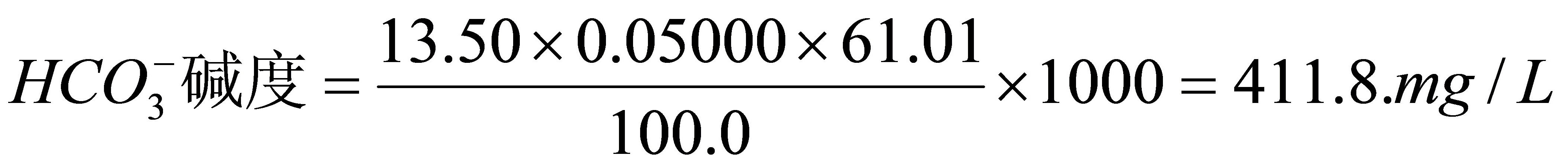
解析
考查要点:本题主要考查水的碱度测定原理及计算,涉及酸碱滴定中指示剂的选择与碱度类型的判断,以及通过滴定数据计算碱度含量。
解题核心思路:
- 判断碱度类型:根据酚酞(V₁)和甲基橙(V₂)的滴定体积关系,确定水样中存在的碱性离子类型。
- 计算碱度含量:利用甲基橙滴定数据,结合化学反应式和摩尔质量,计算对应碱性离子的浓度。
破题关键点:
- 酚酞终点未消耗HCl(V₁=0):说明水样中无OH⁻和CO₃²⁻,否则需先滴定至酚酞终点。
- 甲基橙终点消耗HCl(V₂>0):表明存在HCO₃⁻,需滴定至甲基橙终点。
碱度类型判断
- 酚酞指示剂现象:未滴入HCl即显终点色 → V₁=0,说明水样中无OH⁻和CO₃²⁻(否则需滴定至酚酞终点)。
- 甲基橙指示剂现象:消耗HCl 13.50 mL → V₂>0,说明存在HCO₃⁻,需滴定至甲基橙终点。
结论:水样中仅含HCO₃⁻碱度。
碱度含量计算
化学反应式
HCO₃⁻与HCl反应:
$\text{HCO}_3^- + \text{H}^+ \rightarrow \text{CO}_2 + \text{H}_2\text{O}$
物质的量关系
HCl的物质的量 = HCO₃⁻的物质的量:
$n_{\text{HCl}} = C_{\text{HCl}} \cdot V_{\text{HCl}} = 0.05000 \, \text{mol/L} \cdot 0.01350 \, \text{L} = 0.000675 \, \text{mol}$
转换为质量浓度
HCO₃⁻的摩尔质量 $M = 61.01 \, \text{g/mol}$,水样体积 $V_{\text{水样}} = 100.0 \, \text{mL}$:
$\text{浓度} = \frac{n \cdot M}{V_{\text{水样}}} \cdot 1000 = \frac{0.000675 \cdot 61.01}{0.1} \cdot 1000 = 411.8 \, \text{mg/L}$