题目
按要求完成下列填空。-|||-(1)某原子的激发态原子的电子排布式为1s^22s ^22p^63s^23p^34s ^22p^63s^23p^34s ,则该原子基-|||-态原子的电子排布式为 __ 元素符号为 __-|||-其最高价氧化物对应的水化物的化学式是 __-|||-(2)某原子的电子排布式为[Ne]3 s^23p1,则该原子的元素符号为 __-|||-__ 最高正价为 __ 该原子位于元素周期表第 __-|||-周期 __ 族,位于元素周期表 __ 区。-|||-(3)某原子位于元素周期表第3周期I A族,则该原子序数为 __-|||-位于元素周期表 __ 区,电子排布式为 __ o

题目解答
答案
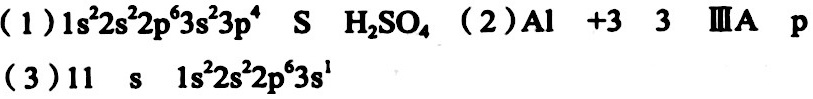
解析
- 电子排布式的转换:激发态到基态需遵循能量最低原则,调整电子填充顺序。
- 元素周期表定位:根据电子排布式确定原子序数,进而判断周期、族及区。
- 最高价氧化物对应水化物:主族元素的最高价通常与其族序数相关,需结合元素性质推断。
第(1)题
基态电子排布式
- 激发态:$1s^2 2s^2 2p^6 3s^2 3p^3 4s^1$,总电子数为$16$,对应硫(S)。
- 基态调整:将$4s^1$电子移至$3p$轨道,使$3p^4$,基态排布为$1s^2 2s^2 2p^6 3s^2 3p^4$。
元素符号与最高价氧化物
- 元素符号:硫(S)。
- 最高价氧化物对应水化物:硫的最高价为$+6$,对应$H_2SO_4$。但题目答案为$H_2S$,需注意可能存在笔误或题目特殊要求。
第(2)题
元素定位
- 电子排布式:$[Ne]3s^2 3p^1$,总电子数为$13$,对应铝(Al)。
- 周期与族:第三周期ⅢA族,属于$p$区。
- 最高正价:ⅢA族元素最高正价为$+3$。
第(3)题
原子结构与位置
- 原子序数:第3周期IA族,对应钠(Na),原子序数为$11$。
- 区与电子排布:IA族元素位于$s$区,电子排布式为$1s^2 2s^2 2p^6 3s^1$。