题目
以铅精矿(含PbS,Ag_(2)S等)为主要原料提取金属Pb和Ag的工艺流程如:含过量FeCl3的饱和食盐水 铅精矿 试剂X-|||-浓盐酸-|||-铅精矿一 热浸 过滤I 稀释、冷却 ][ 过滤Ⅱ 还原 → 过滤Ⅲ → 置换 尾液-|||-含硫滤渣 热溶 含硫滤渣 富银铅泥-|||-电解I → 金属Pb 金属Ag 电解Ⅱ 金属Pb回答下列问题:(1)“热浸”时,难溶的PbS和Ag_(2)S转化为[PbCl_(4)]^2-和[AgCl_(2)]^-及单质硫。溶等物质的量的PbS和Ag_(2)S时,消耗Fe^3+物质的量之比为______;溶液中盐酸浓度不宜过大,除防止“热浸”时HCl挥发外,另一目的是防止产生______(填化学式)。(2)将“过滤Ⅱ”得到的PbCl_(2)沉淀反复用饱和食盐水热溶,电所得溶液可制备金属Pb。“电1”阳极产物用尾液吸收后在工艺中循环使用。利用该吸收液的操作单元为______。(3)“还原”中加入铅精矿的目的是______。(4)“置换”中可选用的试剂X为______(填标号);A.lB.ZnC.PbD.Ag“置换”反应的离子方程式为______。(5)“电Ⅱ”中将富银铅泥制成电极板,用作______(填“阴极”或“阳极”)。
以铅精矿(含$PbS$,$Ag_{2}S$等)为主要原料提取金属$Pb$和$Ag$的工艺流程如:
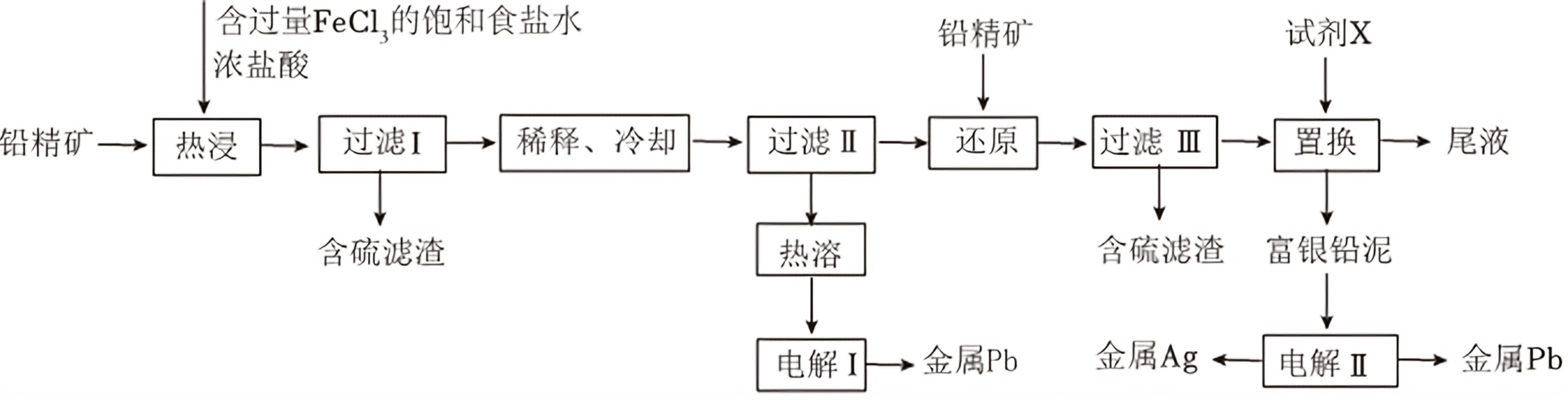
回答下列问题:
$(1)$“热浸”时,难溶的$PbS$和$Ag_{2}S$转化为$[PbCl_{4}]^{2-}$和$[AgCl_{2}]^{-}$及单质硫。溶等物质的量的$PbS$和$Ag_{2}S$时,消耗$Fe^{3+}$物质的量之比为______$;$溶液中盐酸浓度不宜过大,除防止“热浸”时$HCl$挥发外,另一目的是防止产生______$(填化学式)$。
$(2)$将“过滤$Ⅱ$”得到的$PbCl_{2}$沉淀反复用饱和食盐水热溶,电所得溶液可制备金属$Pb$。“电$1$”阳极产物用尾液吸收后在工艺中循环使用。利用该吸收液的操作单元为______。
$(3)$“还原”中加入铅精矿的目的是______。
$(4)$“置换”中可选用的试剂$X$为______$(填标号)$;
$A.l$
$B.Zn$
$C.Pb$
$D.Ag$
“置换”反应的离子方程式为______。
$(5)$“电$Ⅱ$”中将富银铅泥制成电极板,用作______$(填“阴极”或“阳极”)$。

回答下列问题:
$(1)$“热浸”时,难溶的$PbS$和$Ag_{2}S$转化为$[PbCl_{4}]^{2-}$和$[AgCl_{2}]^{-}$及单质硫。溶等物质的量的$PbS$和$Ag_{2}S$时,消耗$Fe^{3+}$物质的量之比为______$;$溶液中盐酸浓度不宜过大,除防止“热浸”时$HCl$挥发外,另一目的是防止产生______$(填化学式)$。
$(2)$将“过滤$Ⅱ$”得到的$PbCl_{2}$沉淀反复用饱和食盐水热溶,电所得溶液可制备金属$Pb$。“电$1$”阳极产物用尾液吸收后在工艺中循环使用。利用该吸收液的操作单元为______。
$(3)$“还原”中加入铅精矿的目的是______。
$(4)$“置换”中可选用的试剂$X$为______$(填标号)$;
$A.l$
$B.Zn$
$C.Pb$
$D.Ag$
“置换”反应的离子方程式为______。
$(5)$“电$Ⅱ$”中将富银铅泥制成电极板,用作______$(填“阴极”或“阳极”)$。
题目解答
答案
(1)溶等物质的量的$PbS$和$Ag_{2}S$时,离子方程式分别为:$PbS+2Fe^{3+}+4Cl^{-}=[PbCl_{4}]^{2-}+S+2Fe^{2+}$、$Ag_{2}S+2Fe^{3+}+4Cl^{-}=2[AgCl_{2}]^{-}+S+2Fe^{2+}$,所以消耗$Fe^{3+}$物质的量之比为$1:1$;溶液中盐酸浓度不宜过大,除防止“热浸”时$HCl$挥发外,另一目的是防止产生$H_{2}S$,$H_{2}S$有毒,
故答案为:$1:1$;$H_{2}S$;
$(2)$热溶后得到的溶液中含有$[PbCl_{4}]^{2-}$和$NaCl$,“电$1$”阳极产物为$Cl_{2}$,尾液为$FeCl_{2}$,二者反应得到$FeCl_{3}$,利用该吸收液的操作单元为热浸,
故答案为:热浸;
$(3)$过滤$Ⅱ$得到的滤液中含有过量的$FeCl_{3}$,根据过滤Ⅲ得到的滤渣成分知,“还原”中加入铅精矿的目的是将过量的$Fe^{3+}$还原为$Fe^{2+}$,
故答案为:将过量的$Fe^{3+}$还原为$Fe^{2+}$;
$(4)$“置换”中可选用的试剂$X$能还原$[AgCl_{2}]^{-}$且不能引进新的杂质,所以$X$为$Pb$,“置换”反应的离子方程式为$2[AgCl_{2}]^{-}+Pb=2Ag+[PbCl_{4}]^{2-}$,
故答案为:$C$;$2[AgCl_{2}]^{-}+Pb=2Ag+[PbCl_{4}]^{2-}$;
$(5)$“电$Ⅱ$”中将富银铅泥制成电极板,电$Ⅱ$得到$Ag$、$Pb$,将$Ag$、$Pb$分离出来,$Pb$比$Ag$活泼,将富银铅泥制成阳极,$Pb$失电子生成$Pb^{2+}$进入电质溶液,$Ag$形成阳极泥,阴极上$Pb^{2+}$得电子生成$Pb$,
故答案为:阳极。
故答案为:$1:1$;$H_{2}S$;
$(2)$热溶后得到的溶液中含有$[PbCl_{4}]^{2-}$和$NaCl$,“电$1$”阳极产物为$Cl_{2}$,尾液为$FeCl_{2}$,二者反应得到$FeCl_{3}$,利用该吸收液的操作单元为热浸,
故答案为:热浸;
$(3)$过滤$Ⅱ$得到的滤液中含有过量的$FeCl_{3}$,根据过滤Ⅲ得到的滤渣成分知,“还原”中加入铅精矿的目的是将过量的$Fe^{3+}$还原为$Fe^{2+}$,
故答案为:将过量的$Fe^{3+}$还原为$Fe^{2+}$;
$(4)$“置换”中可选用的试剂$X$能还原$[AgCl_{2}]^{-}$且不能引进新的杂质,所以$X$为$Pb$,“置换”反应的离子方程式为$2[AgCl_{2}]^{-}+Pb=2Ag+[PbCl_{4}]^{2-}$,
故答案为:$C$;$2[AgCl_{2}]^{-}+Pb=2Ag+[PbCl_{4}]^{2-}$;
$(5)$“电$Ⅱ$”中将富银铅泥制成电极板,电$Ⅱ$得到$Ag$、$Pb$,将$Ag$、$Pb$分离出来,$Pb$比$Ag$活泼,将富银铅泥制成阳极,$Pb$失电子生成$Pb^{2+}$进入电质溶液,$Ag$形成阳极泥,阴极上$Pb^{2+}$得电子生成$Pb$,
故答案为:阳极。