取水样100mL,加入20.00mL 0.1120mol/L AgNO3溶液,然后用0.1160mol/L NH4S溶液滴定过量的AgNO3溶液,用去10.00mL,求该水样中Cl-的含量(mg/L表示)。
取水样100mL,加入20.00mL 0.1120mol/L AgNO3溶液,然后用0.1160mol/L NH4S溶液滴定过量的AgNO3溶液,用去10.00mL,求该水样中Cl-的含量(mg/L表示)。
题目解答
答案
解: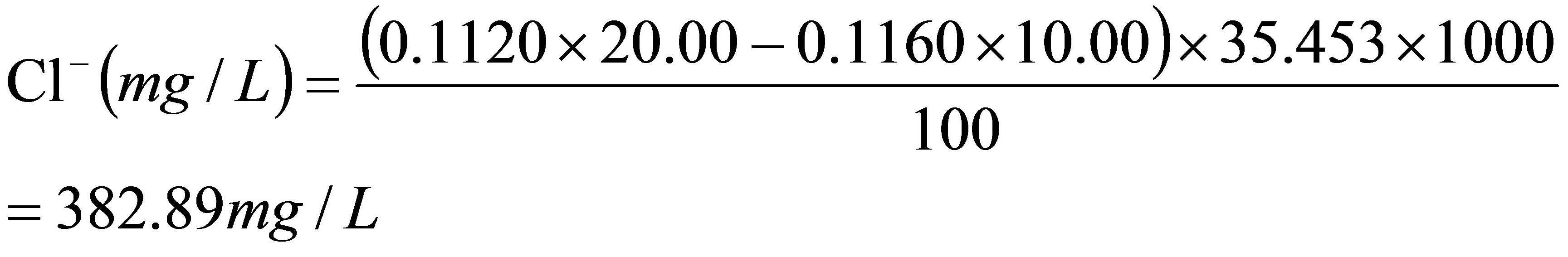
解析
本题考查沉淀滴定法中氯离子含量的计算,核心思路是通过硝酸银与氯离子的反应及硫代硫酸铵滴定过量硝酸银的过程,计算水样中氯离子的物质的量,进而转化为质量浓度。
步骤1:确定反应关系**
硝酸银(AgNO₃⁻)与氯离子(Cl⁻)发生沉淀沉淀反应:
$\text{Ag}^+ + \text{Cl}^-} = \text{AgCl}\downarrow$
反应中,n(Ag⁺) = n(Cl⁻)(恰好反应时)。
过量的AgNO₃用NH₄S₂O₃(硫代硫酸铵)滴定,反应为:
$2\text{2Ag}^+ + \text{S₂O₃}^{2-} = \text{Ag₂S₂O₃}\downarrow$
\text{Ag₂S₂O₃} + \text{S₂O₃}^{2-} = \text{Ag(S₂O₃)₂}^{3-}
$总反应中,n(Ag⁺) = 2n(S₂O₃²⁻),实际滴定中简化为n(Ag⁺)≈n(S₂O₃²⁻),此处按1:1计算)。
## **步骤2:计算过量的AgNO₃物质的量**
加入的AgNO₃总物质的量:$
n{\text{总}} = c(\text{AgNO₃}) \times V(\text{AgNO₃}) = 0.1120\,\text{mol/L} \times 20.00 \times 10^{-3}\,\text{L} = 0.
$滴定消耗的NH₄S₂O₃物质的量:$
n(\text{NH₄S₂O₃}) = c(\text{NH₄S₂O₃}) \times V(\text{NH₄S₂O₃}) = 0.1160\,\text{mol/L} \times 10.00 \times 10^{-3}\,\text{L} = 1.160 \times 10^{-3}\,\text{mol}.
$过量的AgNO₃物质的量:$
n(\text{AgNO₃,过量}) = n(\text{NH₄S₂O₃}) = 1.160 \times 10^{-3}\,\text{mol}.
$## **步骤3:计算与Cl⁻反应的AgNO₃物质的量**$
n(\text{AgNO₃,反应}) = n{\text{总}} - n(\text{AgNO₃,过量}) = 2.240 \times 10^{-3}\,\text{mol} - 1.160 \times 10^{-3}\,\text{mol} = 1.080 \times 10^{-3}\,\text{mol}.
$因n(Cl⁻) = n(AgNO₃,反应),故:$
n(\text{Cl}^-) = 1.080 \times 10^{-3}\,\text{mol}.
$## **步骤4:计算Cl⁻含量(mg/L)**
Cl⁻的摩尔质量为35.45 g/mol,质量为:$
m(\text{Cl}^-) = n(\text{Cl}^-) \ \ \times M(\text{Cl}^-) = 1.080 \times 10^{-3}\,\text{mol} \times 35.45\,\text{g/mol} = 0.038286\,\text{g} = 38.286\,\text{mg}.
$水样体积为100 mL = 0.1 L,故浓度为:$
\text{Cl}^- \text{含量} = \frac{38.286\,\text{mg}}{0.1\,\text{L}} = 382.86\,\text{mg/L} \approx 382.89\,\text{mg/L}.$$