(10分)乙烯是来自石油的重要有机化工原料。结合以下路线回答:(H)_(3)CH=C(H)_(2) (H)_(2)=CH-COOH-|||-(H)_(2)=C(H)_(2) H2O A O2 B O2 C-|||-原油 分馏 重油 裂解 Ⅱ Ⅲ-|||-D E已知:2CH3CHO + O22CH3COOH(1)D是高分子,用来制造包装材料,其结构简式是_________________ 。(2)E有香味,实验室用A和C反应来制取E①反应IV的化学方程式是_______________________________________ 。②实验结束之后,振荡收集有E的试管,有无色气泡产生其主要原因是(用化学方程式表示)______(3)产物CH2=CH-COOH可能发生的反应有____________(填序号)。a. 加成反应 b. 取代反应 c. 氧化反应 d. 中和反应D.W元素的氧化物的水化物是强酸8.下列反应既不属于氧化还原反应,又是吸热反应的是( )A.铝片与稀盐酸的反应B.a(OH)2•8H2O与NH4Cl的反应C.生石灰与水反应D.甲烷在氧气中的燃烧反应9.下列有关电池的说法不正确的是( )A.手机上用的锂离子电池属于二次电池B.锌锰干电池中,锌电极是负极C.氢氧燃料电池可把化学能转化为电能D.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极10.下列过程中发生了加成反应的是( )A.乙烯使酸性高锰酸钾溶液褪色B.乙烯使溴的四氯化碳溶液褪色C.乙烯燃烧生成二氧化碳和水D.光照下甲烷与氯气的混合气体颜色逐渐褪去11.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的3倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法不正确的是( )A.元素A、B组成的化合物常温下一定呈液态B.一定条件下,元素C、D的最高价氧化物对应的水化物之间能发生反应C.工业上常用电解法制备元素C、D、E的单质D.化合物AE与CE含有相同类型的化学键12.下列各离子化合物中,阳离子与阴离子的半径之比最小的是( )A.KCl B.NaBr C.LiI D.KF13.关于胶体的叙述正确的是( )A.胶体带电B.胶体是混合物C.胶体本质特征是丁达尔效应D.胶体都是无色的14.下列热化学方程式书写正确的是(△H的绝对值均正确)A.2H2O(g)=2H2(g)+O2(g) △H=-483.6kJ/mol(△H 代表反应热)B.C(s)+O2(g)=CO2(g)(△H=+393.5kJ/mol(△H代表反应热)C.2HNO3(aq)+Ba(OH)2(aq)=2NaNO3(aq)+2H2O(l)△H=+114.6kJ/mol(△H代表反应热)(4)①A是乙醇,与A相对分子质量相等且元素种类相同的有机物的结构简式是:_____、_____。②为了研究乙醇的化学性质,利用下列装置进行乙醇的催化氧化实验,并检验其产物,其中C装置的试管中盛有无水乙醇。(加热、固定和夹持装置已略去)(H)_(3)CH=C(H)_(2) (H)_(2)=CH-COOH-|||-(H)_(2)=C(H)_(2) H2O A O2 B O2 C-|||-原油 分馏 重油 裂解 Ⅱ Ⅲ-|||-D E1)装置A圆底烧瓶内的固体物质是________,C中热水的作用是__________。2)实验时D处装有铜粉,点燃D处的酒精灯后,D中发生的主要反应的化学方程式为__________,当反应进行一段时间后,移去酒精灯,D中仍然继续反应,说明D处发生的反应是一个________反应(填“吸热”或“放热”)。.
(10分)乙烯是来自石油的重要有机化工原料。结合以下路线回答:
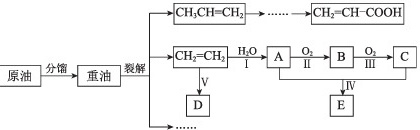
已知:2CH3CHO + O22CH3COOH
(1)D是高分子,用来制造包装材料,其结构简式是_________________ 。
(2)E有香味,实验室用A和C反应来制取E
①反应IV的化学方程式是_______________________________________ 。
②实验结束之后,振荡收集有E的试管,有无色气泡产生其主要原因是(用化学方程式表示)______
(3)产物CH2=CH-COOH可能发生的反应有____________(填序号)。
a. 加成反应 b. 取代反应 c. 氧化反应 d. 中和反应
D.W元素的氧化物的水化物是强酸
8.下列反应既不属于氧化还原反应,又是吸热反应的是( )
A.铝片与稀盐酸的反应B.a(OH)2•8H2O与NH4Cl的反应
C.生石灰与水反应D.甲烷在氧气中的燃烧反应
9.下列有关电池的说法不正确的是( )
A.手机上用的锂离子电池属于二次电池
B.锌锰干电池中,锌电极是负极
C.氢氧燃料电池可把化学能转化为电能
D.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
10.下列过程中发生了加成反应的是( )
A.乙烯使酸性高锰酸钾溶液褪色
B.乙烯使溴的四氯化碳溶液褪色
C.乙烯燃烧生成二氧化碳和水
D.光照下甲烷与氯气的混合气体颜色逐渐褪去
11.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的3倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法不正确的是( )
A.元素A、B组成的化合物常温下一定呈液态
B.一定条件下,元素C、D的最高价氧化物对应的水化物之间能发生反应
C.工业上常用电解法制备元素C、D、E的单质
D.化合物AE与CE含有相同类型的化学键
12.下列各离子化合物中,阳离子与阴离子的半径之比最小的是( )
A.KCl B.NaBr C.LiI D.KF
13.关于胶体的叙述正确的是( )
A.胶体带电
B.胶体是混合物
C.胶体本质特征是丁达尔效应
D.胶体都是无色的
14.下列热化学方程式书写正确的是(△H的绝对值均正确)
A.2H2O(g)=2H2(g)+O2(g) △H=-483.6kJ/mol(△H 代表反应热)
B.C(s)+O2(g)=CO2(g)(△H=+393.5kJ/mol(△H代表反应热)
C.2HNO3(aq)+Ba(OH)2(aq)=2NaNO3(aq)+2H2O(l)△H=+114.6kJ/mol(△H代表反应热)
(4)①A是乙醇,与A相对分子质量相等且元素种类相同的有机物的结构简式是:_____、_____。
②为了研究乙醇的化学性质,利用下列装置进行乙醇的催化氧化实验,并检验其产物,其中C装置的试管中盛有无水乙醇。(加热、固定和夹持装置已略去)
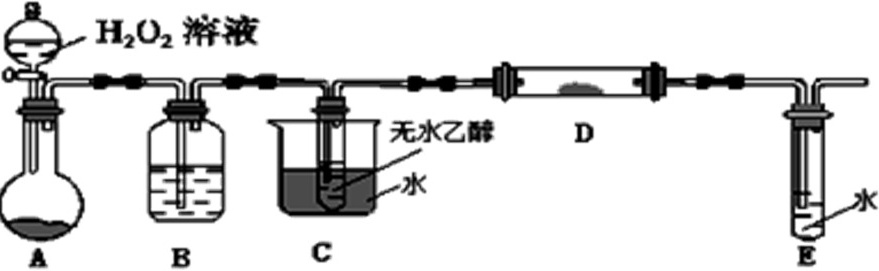
1)装置A圆底烧瓶内的固体物质是________,C中热水的作用是__________。
2)实验时D处装有铜粉,点燃D处的酒精灯后,D中发生的主要反应的化学方程式为__________,当反应进行一段时间后,移去酒精灯,D中仍然继续反应,说明D处发生的反应是一个________反应(填“吸热”或“放热”)。
.题目解答
答案
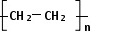 CH3COOH + C2H5OH
CH3COOH + C2H5OH CH3COOC2H5 + H2O 2CH3COOH + Na2CO3=2CH3COONa + H2O + CO2↑ a b c d HCOOH CH3OCH3 MnO2 使乙醇汽化成乙醇蒸气 2CH3CH2OH+O22
CH3COOC2H5 + H2O 2CH3COOH + Na2CO3=2CH3COONa + H2O + CO2↑ a b c d HCOOH CH3OCH3 MnO2 使乙醇汽化成乙醇蒸气 2CH3CH2OH+O22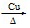 CH3CHO+2H2O 放热
CH3CHO+2H2O 放热